
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
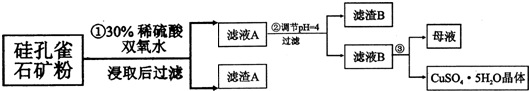
分析 硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质,硅孔雀石矿粉加入稀硫酸溶解,加入过氧化氢氧化亚铁离子浸取后过滤,得到滤渣主要为SiO2、H2SiO3,滤液A在含有Cu2+、Fe3+、Al3+、H+,加入铜的化合物调节溶液pH=4使铁离子全部沉淀,此时铝离子有部分沉淀,过滤得到滤液B主要是硫酸铜溶液,含有少量硫酸铝和硫酸溶液,通过蒸发浓缩蒸发,冷却结晶得到硫酸铜晶体,
(1)双氧水将亚铁离子氧化成铁离子的离子方程式;
(2)加入的试剂能够消化氢离子,但是不能引进新的杂质进行分析;
(3)依据表中离子沉淀的pH值判断调节溶液酸碱性除去杂质剩余的离子;
(4)依据从蒸发结晶的正确操作解答;
(5)由题意硫化铜与氧气反应生成硫酸铜,依据化合价升降守恒结合原子个数守恒配平方程式;
设CuO的物质的量为x,Cu20的物质的量为y,依据氧原子个数守恒计算生成的CuO和Cu20,然后计算n(Cu):n(O).
解答 解:(1)双氧水将亚铁离子氧化成铁离子的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)加入的试剂能够中和溶液中的氢离子,还不能引进新的杂质,所以应该选用B.氧化铜、C.CuC03•Cu(OH)2,
故选BC;
(3)由上表可知:当溶液pH=4时,可以完全除去三价铁离子,铝离子完全沉淀的pH值为5.2,所以只有部分铝离子沉淀,而溶液中剩余铜离子、铝离子和氢离子;
故答案为:Al3+、H+、Cu2+;
(4)从硫酸铜溶液中得到硫酸铜晶体应经过蒸发浓缩、冷却结晶;
故答案为:蒸发浓缩、冷却结晶;
(5)由题意硫化铜与氧气反应生成硫酸铜,依据化合价升降守恒结合原子个数守恒配平方程式:CuS+2O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CuSO4;
384g CuS物质的量=$\frac{384g}{94g/mol}$=4mol,设CuO的物质的量为x,Cu20的物质的量为y,依据方程式2CuS+302=2CuO+2S02和4CuS+502=2Cu20+4S02,
则依据铜原子个数守恒可知:x+2y=4;
依据氧原子个数守恒可知:$\frac{1}{2}$x+$\frac{1}{2}$y+4=b×$\frac{1}{5}$;
解得:x=0.8b-20,y=12-0.4b,
所以n(Cu):n(O)=4:a=4:(x+y)=4:($\frac{2}{5}$b-8);
所以a=$\frac{2}{5}$b-8.
故答案为:CuS+2O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CuSO4;$\frac{2}{5}$b-8.
点评 本题借助硅孔雀石为原料制取硫酸铜的工艺流程,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的熬成,题目侧重考查了化学方程式书写、误差分析、化学计算等知识,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在河流入海口处易形成三角州 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 用石膏或盐卤点制豆腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热△H | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和NH3•H2O反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (Q1+Q2+Q3) kJ | B. | 0.5(Q+Q2+Q3) kJ | ||
| C. | (0.5Q1-1.5Q2+0.5Q3) kJ | D. | -(3Q1-Q2+Q3) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
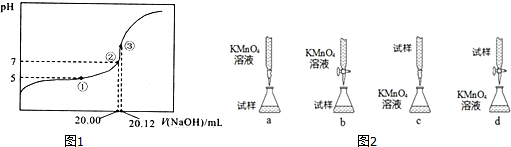
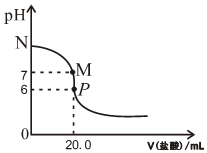 298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.
298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com