
【实验化学】硫酸锌是一种重要的工业原料。在实验室从粗锌(含有少量的铅)与稀硫酸反应后的废液中提取硫酸锌的主要操作步骤如下:
步骤1:将废液过滤,调节滤液的pH约为2,过滤,将滤液加热浓缩,制得较高温度下的饱和溶液,冷却结晶得到粗制晶体。
步骤2:①在烧杯中用蒸馏水溶解步骤1得到的晶体,滴加少量稀硫酸,水浴加热至晶体全部溶解。
②停止加热,让其自然冷却、结晶。
③抽滤,用少量无水乙醇洗涤晶体1~2次,得精制晶体。
(1)废液中含有的不溶性杂质是________。
(2)步骤1中调节滤液pH约为2,可加入的物质是________(填字母)。
a.NH3·H2O b.ZnO c.ZnCO3 d.NaOH
(3)步骤1中对滤液加热浓缩时,当________时,停止加热。
(4)步骤2中滴加少量稀硫酸的目的是____。
(5)抽滤装置如图所示,仪器B的名称是________。仪器C的作用是____________。
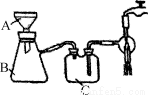
(6)用少量无水乙醇洗涤晶体的目的是________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:简答题
(13分)(1)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) 2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。

①该反应的平衡常数表达式为K=___。升高温度,平衡常数将____(填“增大”“减小 ”或“不变”)。
”或“不变”)。
②能判断该反应是 否达到化学平衡状态的依据是________。
否达到化学平衡状态的依据是________。
A.容器中压强不 变
变
B.混合气体的密度不变
C.υ(A):υ(B):υ(C)=2:1:2
D.c(A)=c( C)
C)
(2)为研究不同条件对反应2NO(g)+Cl2(g) 2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为
2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为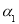 。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为
。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为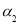 ,则
,则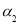 __________
__________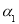 ,(填“大于”“小于”或“等于”)。
,(填“大于”“小于”或“等于”)。
(3)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2—离子。电池工作时负极反应式为_________________。用该燃料电池作电源,以石墨为电极电解足量的硫酸铜溶液,当电路中通过0.1 mol电子时,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____(填物质名称),其 质量约为_______g。
质量约为_______g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第二次模拟化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是:
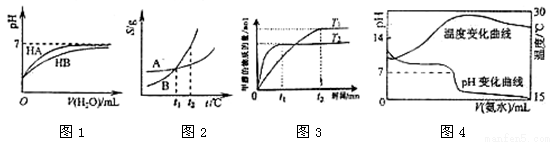
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B﹥A。
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应。
D.图4表示将1.000 mol/L氨水滴入20.00mL1.000 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市、石嘴山市高三四月联考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为 (用元素符号表示)。
(3)BD32-中心原子杂化轨道的类型为________杂化;CA4+的空间构型为__________(用文字描述)。
(4)1mol BC-中含有π键的数目为______NA。
(5)D、E元素最简单氢化物的稳定性 _____> _____ (填化学式),理由是 。
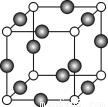
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 _____ ,C原子的配位数是 _____。若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为______g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市、石嘴山市高三四月联考理综化学试卷(解析版) 题型:选择题
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH + O2=CH3COOH + H2O。下列有关说法不正确的是
A.检测时,电解质溶液中的H+向正极移动
B.若有 0.4 mol电子转移,则消耗 2.24 L氧气
C.正极上发生还原反应,负极上发生氧化反应
D.负极上的反应为:CH3CH2OH - 4e- + H2O==CH3COOH + 4H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:推断题
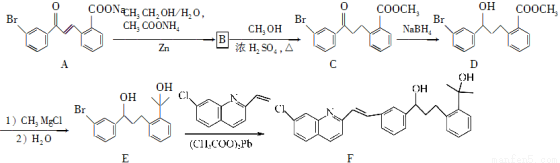
(15分)化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下:
请回答下列问题:
(1)化合物C中含氧官能团为________、________(填名称)。
(2)化合物B的分子式为C16H13O3Br,则B的结构简式为____________。
(3)由C→D、E→F的反应类型依次为________、________。
(4)写出符合下列条件C的一种同分异构体的结构简式:______________。
Ⅰ.属于芳香族化合物,且分子中含有2个苯环;
Ⅱ.能够发生银镜反应;
Ⅲ.分子中有5种不同环境的氢原子。
(5)已知:RCl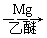 RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、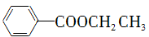 为原料制备
为原料制备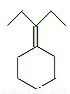 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
H2C=CH2 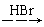 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列关于各图象的解释或得出的结论正确的是
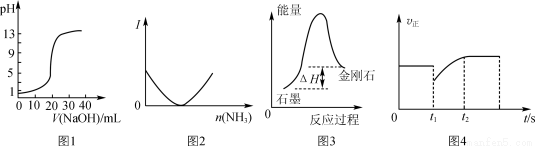
A.图1表示用0.10 mol·L-1 NaOH溶液滴定20.00 mL 0.10 mol·L-1醋酸溶液的滴定曲线
B.图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化
C.根据图3所示可知:石墨比金刚石稳定
D.图4表示反应2SO2+O2 2SO3,t1时刻只减小了的SO3的浓度
2SO3,t1时刻只减小了的SO3的浓度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:
A(g)+B(g) 2C(g)+D(s) △H=a kJ·mol-1
2C(g)+D(s) △H=a kJ·mol-1
实验内容和结果分别如下表和下图所示。下列说法正确的是
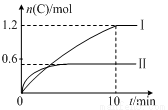
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 1.5 mol | 0.5 mol | —— |
A.实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B.上述方程式中a=-160
C.600 ℃时,该反应的平衡常数是0.45
D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:推断题
姜黄素具有搞突变和预防肿瘤的作用,其合成路线如下:
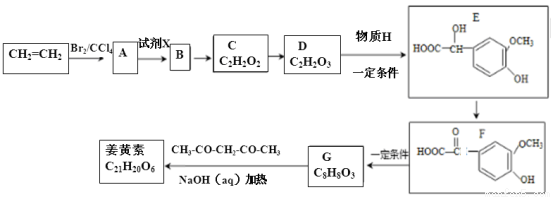
已知:①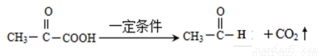
②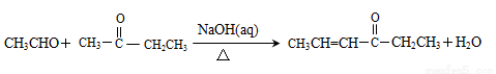
请回答下列问题:
(1)D中含有的官能团名称是_____________。D→E的反应类型是__________。
(2)姜黄素的结构简式为_______________________________。
(3)反应A→B的化学方程式为__________________________________。
(4)D的催化氧化产物与B可以反应生成一种高分子化合物,其结构简式为 。
(5)下列有关E的叙述不正确的是 (填正确答案编号)。
a.E能发生氧化、加成、取代和缩聚反应
b.1molE与浓溴水反应最多消耗3mol的Br2
c.E能与FeCl3溶液发生显色反应
d.1molE最多能与3molNaOH发生反应
(6)G(C8H8O3)的同分异构体中,符合下列条件的共有 种。
①苯环上的一取代物只有2种;
②1mol该物质与烧碱溶液反应,最多消耗3molNaOH.
其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com