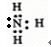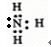【答案】
分析:根据M是地壳中含量最高的金属元素及地壳中元素的含量可知M为铝元素,再由X、Y、Z、L是组成蛋白质的基础元素及元素的原子序数依次增大,则X、Y、Z、L分别为氢、碳、氮、氧;
(1)利用原子结构及元素周期律来解答;(2)根据原子数写化学式,再由最外层电子数来分析电子式和结构式;(3)根据最外层电子数分析最高化合价,然后书写最高价氧化物对应的水化物化学式,利用气态氢化物的稳定来分析生成1mol硒化氢的反应热;(4)根据电解原理及信息生成难溶物R,R受热分解生成化合物Q来解答.
解答:解:根据M是地壳中含量最高的金属元素及地壳中元素的含量可知M为铝元素,再由X、Y、Z、L是组成蛋白质的基础元素及元素的原子序数依次增大,则X、Y、Z、L分别为氢、碳、氮、氧;
(1)因L为氧元素,其元素符号为O,M为铝元素,铝在第三周期、第ⅢA族,再由电子层越多,半径越大,同周期元素随原子序数的增大,半径在减小,故答案为:O;第三周期、第ⅢA族;Al>C>N>O>H;
(2)因Z、X两元素分别为N、H元素,原子数目比l:3和2:4构成分子A和B分别为NH
3、N
2H
4,氮原子在分子中满足最外层8电子结构,故答案为:

;

;
(3)L为氧元素,Se与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为8+8+18=34,其最外层电子数为6,则最高化合价为6,最高价氧化物对应的水化物化学式为H
2SeO
4,该族2~5周期元素单质分别与H
2反应生成的气态氢化物的稳定性为H
2O>H
2S>H
2Se>H
2Te,则生成1mol水时放热最多,则生成1molH
2O、H
2S、H
2Se、H
2Te的反应热分别为d、c、b、a,即生成1mol硒化氢反应热的是b,故答案为:34;H
2SeO
4;b;
(4)因M为铝,则M单质作阳极,铝失去电子,在NaHCO
3溶液作电解液时铝离子与碳酸氢根离子在阳极反应,其反应为Al+3HCO
3--3e
-=Al(OH)
3↓+CO
2↑
(或Al-3e
-=Al
3+、Al
3++3HCO
3-=Al(OH)
3↓+CO
2↑),则R为氢氧化铝,氢氧化铝分解生成氧化铝和水,其反应为2Al(OH)
3 
Al
2O
3+2H
2O,
故答案为:Al+3HCO
3--3e
-=Al(OH)
3↓+CO
2↑(或Al-3e
-=Al
3+、Al
3++3HCO
3-=Al(OH)
3↓+CO
2↑);2Al(OH)
3 
Al
2O
3+2H
2O.
点评:本题考查元素周期表和周期律来推断元素,再利用元素化合物知识来解答,考查点多,注重对高中化学的热点、常考考点的考查,学生应加强对这几个知识点的归纳学习.

 ;
; ;
; Al2O3+2H2O,
Al2O3+2H2O, Al2O3+2H2O.
Al2O3+2H2O.