
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl-
B.使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl-
C.0.1mol/LNaHCO3溶液:K+、AlO2-、Cl-、NO3-
D.0.1mol/L(NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:填空题
铁及其化合物有重要用途,如聚合硫酸铁[]是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
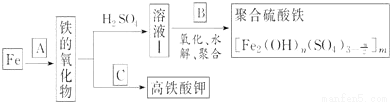
请回答下列问题:
(1)若A为H2O(g),写出反应方程式___________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)_________________;
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol?L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 ; I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象__________________________;
②溶液Ⅰ中铁元素的总含量为__________ g?L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第四次摸底考试化学试卷(解析版) 题型:选择题
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中,一定能大量共存的是
A.a点对应的溶液中:Na+、OH-、SO42 -、NO3-
B.b点对应的溶液中:Al3+、Fe3+,MnO4- 、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3- 、Cl-
D.d点对应的溶液中:F-、NO3- 、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第二次质检化学试卷(解析版) 题型:填空题
氨气在生产、生活和科研中应用十分广泛 。
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ/mol
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ/mol
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=_____________kJmol。
②液氨可以发生电离:2NH3(l) NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
(2)氨气易液化,便于储运,可利用NH3作储氢材料已知:2NH3(g) N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
①氨气自发分解的反应条件是________________(填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度 的变化如图所示。
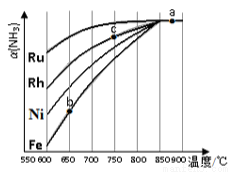
在600℃时催化效果最好的是________________(填催化剂的化学式)。c点氨气的转化率高于b点, 原因是________________。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
①写出电解时A极的电极反应式:________________。
②写出第二步反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省滕州市高一上学期12月月考化学试卷(解析版) 题型:实验题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
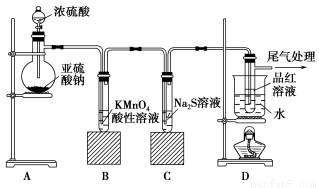
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为________________
(2)实验过程中,装置B、C中发生的现象分别是________________、________________,这些现象分别说明SO2具有的性质是____________和____________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________
(4)尾气可采用__________溶液吸收。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省邵阳市高一上学期第三次月考化学试卷(解析版) 题型:选择题
有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为
A.40 mL B.72 mL C.80 mL D.128 mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一上学期期末考试化学试卷(解析版) 题型:实验题
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图实验装置回答问题
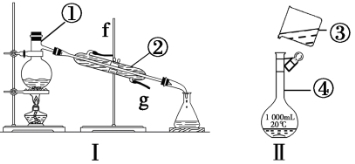
(1)写出下列仪器的名称:① ,② ,④ 。
(2)仪器①~④中,使用时必须检查是否漏水的是 (填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器 ,将仪器补充完整后进行的实验操作的名称为 ;②的进水口是 (填“f”或“g”)。
(4)现需配制250 mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误之处:① ;② 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上诊断检测化学试卷(解析版) 题型:选择题
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如下:
AgCl | AgI | Ag2S | |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com