
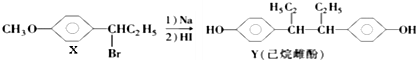
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与Br2发生加成反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
分析 A.卤代烃发生消去反应需要在NaOH的醇溶液中加热;
B.Y中含有酚羟基而不含碳碳双键,能与浓溴水发生取代反应;
C.X中不含酚羟基、Y中含有酚羟基,所以Y具有酚的性质、X没有酚的性质;
D.连接4个不同原子或原子团的C原子为手性碳原子.
解答 解:A.卤代烃发生消去反应需要在NaOH的醇溶液中加热,在NaOH的水溶液中加热发生取代反应,故A错误;
B.Y中含有酚羟基而不含碳碳双键,能与浓溴水发生取代反应而不能发生加成反应,故B错误;
C.X中不含酚羟基、Y中含有酚羟基,所以Y具有酚的性质、X没有酚的性质,所以可以用氯化铁溶液鉴别X、Y,故C正确;
D.连接4个不同原子或原子团的C原子为手性碳原子,该分子中连接乙基的碳原子为手性碳原子,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,利用物质性质差异性鉴别,注意卤代烃发生水解反应、消去反应区别,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液呈中性,可选用甲基橙或酚酞作指示剂 | |
| B. | 溶液呈中性,只能选用石蕊作指示剂 | |
| C. | 溶液呈碱性,可选用甲基橙或酚酞作指示剂 | |
| D. | 溶液呈碱性,只能选用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或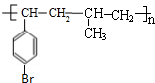 .
.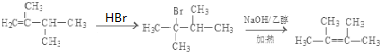 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
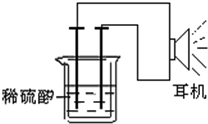 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4+4CO=3Fe+4CO2△H=-14kJ•mol-1 | |
| B. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-22kJ•mol-1 | |
| C. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=+14kJ•mol-1 | |
| D. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-14kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ;⑪
;⑪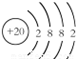 .
. ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com