
| A、2.5mol?L-1 28.57% |
| B、2.2mol?L-1 23.07% |
| C、1.5mol?L-1 24.55% |
| D、2.5mol?L-1 18.37% |
| 0.5mol |
| 0.2L |
| 0.5mol×16g/mol |
| 28g |


科目:高中化学 来源: 题型:
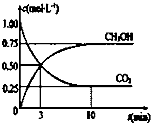 目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.
目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.| c(CH3OH) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3=Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: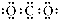 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaNO2发生氧化反应 |
| B、每生成1molN2时转移电子的物质的量为6mol |
| C、N2既是氧化产物,又是还原产物 |
| D、NH4Cl中的氮元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成原子个数比为1:1的化合物只有两种 |
| B、Y、W的氧化物均为酸性氧化物 |
| C、最高价氧化物对应水化物的酸性Y<W |
| D、X与Z形成的化合物中,各原子均满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ |
| D、向NaOH溶液中滴入少量AlCl3溶液:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、尿素是人类第一次合成的蛋白质 |
| B、光导纤维和合成纤维都属于有机高分子材料 |
| C、苯、汽油、无水乙醇都是纯净物 |
| D、煤经气化和液化两个化学变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 温度(℃) | 300 | 400 | 500 |
| K② | 3.1×1015 | 1.66×1014 | 5.3×1013 |
| K③ | 4.0×1020 | 3.6×1018 | 5.7×1017 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com