
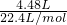 =0.2mol,反应剩余的固体为碳酸钠、硫酸钠,溶于足量BaCl2溶液中,过滤,干燥,可得到白色沉淀22.4g为碳酸钡、硫酸钡,令原混合物中碳酸铵、硫酸铵的物质的量分别为xmol、ymol,则:
=0.2mol,反应剩余的固体为碳酸钠、硫酸钠,溶于足量BaCl2溶液中,过滤,干燥,可得到白色沉淀22.4g为碳酸钡、硫酸钡,令原混合物中碳酸铵、硫酸铵的物质的量分别为xmol、ymol,则:
 计算氨气的物质的量.反应剩余的固体为碳酸钠、硫酸钠,溶于足量BaCl2溶液中,过滤,干燥,可得到白色沉淀22.4g为碳酸钡、硫酸钡,令原混合物中碳酸铵、硫酸铵的物质的量分别为xmol、ymol,根据氮元素守恒以及碳酸钡、硫酸钡的质量之和列方程,计算x、y的值,据此解答.
计算氨气的物质的量.反应剩余的固体为碳酸钠、硫酸钠,溶于足量BaCl2溶液中,过滤,干燥,可得到白色沉淀22.4g为碳酸钡、硫酸钡,令原混合物中碳酸铵、硫酸铵的物质的量分别为xmol、ymol,根据氮元素守恒以及碳酸钡、硫酸钡的质量之和列方程,计算x、y的值,据此解答.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年北京市西城区高一(上)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com