
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H ="
-92" kJ·mol-1
2NH3(g) △H ="
-92" kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
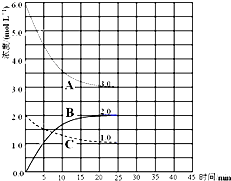
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:

① 表示N2的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。
若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(5分)(1) ac (填序号)。(2)①C
② 0.12mol/(L·min) 。
③4/27 减小。
【解析】
试题分析:(1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题。
b、无论反应是否达到平衡状态,容器内气体的密度都不发生变化,不能判断是否达到平衡状态,故错;d、都为正速率,故错;e、物质的浓度不能判断化学平衡状态,故错。故选ac。
(2)①N2是反应物,结合化学方程式分析,H2的曲线变化快,而N2的变化慢,表示N2的浓度变化的曲线是C。②根据v=△c÷t公式计算得,前25 min 内,用H2的浓度变化表示的化学反应平均速率是0.12mol/(L·min) 。③平衡常数等于生应物的幂之积除以反应物的幂之积,故平衡常数K =4/27。反应为放热反应,升高温度,反应逆向移动,故若升高温度,该反应的平衡常数值将减小。
考点:化学平衡的计算 热化学方程式 电极反应和电池反应方程式 化学平衡的影响因素
点评:本题考查化学平衡计算、平衡常数、热化学方程式、原电池等,综合较大,难度中等,注意两电极反应式相加得总反应式时,两电极得失电子数应相等。


科目:高中化学 来源: 题型:
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.| 1 | 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
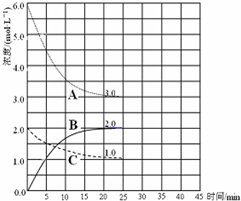 合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象
合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象| A、前25min内,用H2浓度变化表示的化学反应平均速率是0.04 mol?L-1?min-1 | B、在25min 末反应刚好达到平衡,则该温度下反应的平衡常数K=0.148 | C、该反应达到平衡时放出热量为92kJ | D、V正(N2)=2V逆(NH3)说明到达平衡状态 |
查看答案和解析>>
科目:高中化学 来源:2013届浙江省宁波一中2013届高三12月月考化学试卷(带解析) 题型:填空题
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。
若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com