
| A. | 1molCl2 与过量乙烷在光照下反应,生成的有机物中含有氯原子的总数为2NA | |
| B. | 1molC3H8 中含有的共用电子对数为11NA | |
| C. | 1.5g 甲基含有的质子数和电子数之和为1.8NA | |
| D. | 标况下,11.2 L癸烷含有的原子个数为16 NA |
分析 A、1m含10ol氯气和乙烷反应后,其中的1mol氯原子到了无机产物HCl中;
B、丙烷中含10对共用电子对;
C、求出甲基的物质的量,然后根据甲基中含9个电子和9个质子来分析;
D、标况下癸烷为液态.
解答 解:A、1m含10ol氯气和乙烷反应后,其中的1mol氯原子到了无机产物HCl中,故在生成的有机产物中氯原子为NA个,故A错误;
B、丙烷中含10对共用电子对,故1mol丙烷中含10NA对共用电子对,故B错误;
C、1.5g甲基的物质的量为0.1mol,而甲基中含9个电子和9个质子,故共含18个,则0.1mol甲基中含质子和电子共1.8NA个,故C正确;
D、标况下癸烷为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜基态原子核外电子排布式为1s22s22p63s23p64s13d10 | |
| B. | 在d轨道中电子排布成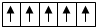 而不是 而不是 ,其最直接的根据是泡利原理 ,其最直接的根据是泡利原理 | |
| C. | 下列轨道的能量是按由高到低排列的E5s>E4s>E3d>E2p>E1s | |
| D. | 焰色反应、激光、霓虹灯光等与原子核外电子发生跃迁释放能量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的乙醇溶液中分子总数为0.1NA | |
| B. | 常温常压下,28 g乙烯含有的电子数为16NA | |
| C. | 44g乙酸乙酯和丁酸的混合物中共含有碳原子数为2 NA | |
| D. | m g丙烯和戊烯的混合物中共用电子对数为$\frac{3m}{14}$NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
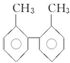
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
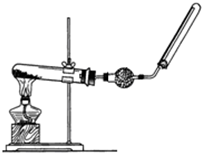 实验室中若用如图所示的装置制取并收集干燥的氨气.
实验室中若用如图所示的装置制取并收集干燥的氨气.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com