
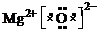 .
.分析 Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z和W元素形成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,根据U、V、W、X、Y、Z是原子序数依次增大可知V为N元素,以此解答该题.
解答 解:Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z和W元素形成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,根据U、V、W、X、Y、Z是原子序数依次增大可知V为N元素,
(1)Z为Fe元素,原子序数为26,位于元素周期表中第四周期,第VIII族,XW为MgO,为离子化合物,电子式为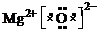 ,
,
故答案为:第四周期,第VIII族; 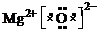 ;
;
(2)氨气为碱性气体,易与酸反应,则易结合氢离子,一般用KSCN溶液检验铁离子,可观察到溶液变为红色,
故答案为:NH3>H2O;KSCN;溶液变红色;
(4)SO2具有较强还原性,可用强氧化性物质HNO3发生氧化还原反应,生成硫酸,加入氯化钡生成硫酸钡沉淀,反应的离子方程式为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+.
点评 本题考查元素推断题,为高考常见题型和高频考点,侧重于学生的分析能力的考查,题目较为综合,涉及电子式、以及氧化还原反应等问题,本题的关键是正确推断元素的种类,注意把握比较问题的角度.


科目:高中化学 来源: 题型:选择题
| A. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-2b kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ•mol-1 | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g);△H=-4b kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=b kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和氢气 | B. | 氯气和溴 | C. | 铝和铁 | D. | 碳和硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

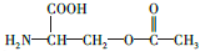 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com