
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 天然气是二次能源 | B. | 石油是二次能源 | ||
| C. | 电力室一次能源 | D. | 水力是一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
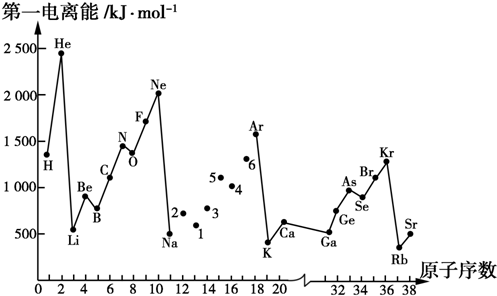
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 通常状况下,2.24LNO2和N2O4的混合气体中氮原子和氧原子数比为1:2 | |
| D. | 1mol•L-1的Na2CO3溶液中所含阴离子数大于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | 整个过程中阳极先产生Cl2,后产生O2 | |
| D. | CD段表示的电解过程中水的电离被促进 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
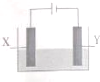 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是| A. | 精炼铜时,电解质为硫酸铜溶液.Y电极反应为:Cu2++2e+=Cu | |
| B. | 精炼铜时,溶液中Ag+、Zn2+、Fe2+浓度增大 | |
| C. | X电极为石墨,Y电极为Cu,则铜收到保护 | |
| D. | X电极为Fe,Y电极为Cu,则铁收到保护 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
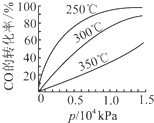 强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.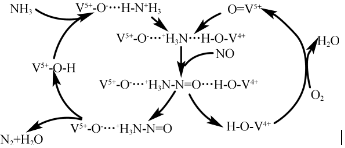
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.05mol•L1Fe2(SO4)3溶液中含Fe3+数目小于0.1NA | |
| B. | 30g甲醛中含4NA对电子 | |
| C. | 7.8g过氧化钠中含有0.1NA个阴离子 | |
| D. | 标准状况下,22.4L乙烷含有的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com