
【题目】某中学化学兴趣小组,将一包白色粉末(NaHCO3和Na2CO3的混合物)进行定量分析。现称取一份质量为27.4 g的样品,将此样品加热灼烧至质量不再变化,取出剩余物质,冷却后称重,质量为21.2g。
(1)写出加热时发生反应的化学方程式:___。
(2)分别求出该样品中NaHCO3和Na2CO3的物质的量。____、____(写出计算过程)
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑ 0.2mol 0.1mol
Na2CO3+H2O+CO2↑ 0.2mol 0.1mol
【解析】
(1)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(2)设碳酸氢钠的质量为x:
2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
168 (18+44=62)
x 27.4 g-21.2g=6.2g
168:x=62:6.2g
x=16.8g
NaHCO3和Na2CO3混合物中NaHCO3的物质的量为:
16.8g÷84g·mol-1=0.2mol.
NaHCO3和Na2CO3混合物中Na2CO3的物质的量为:
(27.4g-16.8g)÷106g·mol-1=0.1mol。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
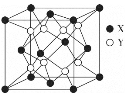
【题目】锆(Zr)是40号元素,位于第五周期ⅣB族,锆可溶于氢氟酸和王水,锆及其化合物在陶瓷、耐火材料等多个领域有着重要用途。请回答下列相关问题。
(1)基态锆原子的价电子排布图(轨道表示式)是___。
(2)ZrSiO4和ZrSiO3是锆的两种硅酸盐,二者含有的阳离子Zr4+和Zr2+中比较稳定的是____,原因是___。SiO32-的空间构型是____,SiO42-中的Si原子的杂化类型是____。
(3)[Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___(填元素符号),该离子中含有的化学键种类不包括___(填选项序号)。
A.极性键 B.非极性键 C.σ键 D.π键
(4)立方氧化锆是一种人工合成的氧化物,由于硬度极高且外观接近钻石常被用作钻石的替代品,其晶胞结构如图所示,立方氧化锆的化学式是___,锆原子的配位数是____。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应过程能量变化如图所示,下列说法正确的是
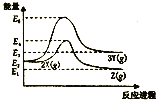
A. 由X→Y反应的ΔH=E2-E3
B. 降低压强有利于提高X→Z的转化率
C. 升高温度有利于提高X→Z的反应速率
D. 由图可知,等物质的量的Y的能量一定比X的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24L Cl2溶于水或NaOH溶液中转移的电子数均为0.1NA
B. 常温常压下,18g H2O含有的氢原子总数为NA
C. 2.3g钠在足量的氧气中燃烧,转移的电子数为0.1NA
D. 0.1mol CH3OH中所含C-H键的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.

(1)该浓盐酸中HCl的物质的量浓度为 ______ molL-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______ .
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次并在操作步骤空白处填上适当仪器名称) ______ .
A.用30mL水洗涤 ______ 2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用 ______ 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括 号内填“偏大”,“偏小”,或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面 ______
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是元素周期表中前四周期的元素,他们的原子序数依次增大,并且不在同一个周期。元素X的原子核外有8个运动状态不同的电子。元素Y基态原子的最外电子层没有空轨道,而且成对电子数是未成对电子数的2倍。元素Z基态原子的内层轨道全部排满电子,且最外层电子数为2。
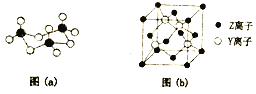
(1)基态X原子的核外电子排布图(轨道表达式)为_________,X的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是________________________。
(2)X与Y形成的固体YX3中存在(a)所示的三聚分子,该分子中Y原子的杂化轨道类型为_______。基态Y原子中,核外能级最高的原子轨道上,具有的电子数为______。
(3)X与Y还可以形成YX42-离子,YX42-的空间构型为_________,写出一种与YX42-互为等电子体的分子的化学式________。
(4)Z与Y的离子形成化合物晶体的晶胞如图(b)所示。在晶胞中,Z离子的配位数为_________,该化合物的化学式为______。
(5)Z的氯化物与氨水反应可形成配合物[Z(NH3)4]Cl2,1mol该配合物中含有![]() 键的数目为_______。
键的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 3.01×1023个OH的物质的量为________mol,含有质子的物质的量为_____mol,含有电子的物质的量为________mol,这些OH和________g Na+含有的电子数相同。
(2)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为______;
(3)等质量的SO2和SO3的物质的量之比_______;氧原子个数比为_________;
(4)11.1gCaCl2固体溶于水配成500mL溶液,其浓度为_____ mol·L-1,从中取出100 mL溶液,其中Cl-的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
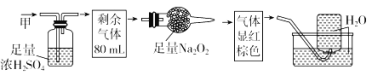
A. NH3、NO2、N2B. NH3、NO、CO2
C. NH3、NO2、CO2D. NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com