

| A. | t1时减小了A(g)的浓度,增加了C(g)的浓度,平衡向逆反应方向移动 | |
| B. | t1时升高了温度,平衡向逆反应方向移动 | |
| C. | t1时增加了A(g)和B(g)的浓度,平衡向正反应方向移动 | |
| D. | t1时减小了压强,平衡向逆反应方向移动 |
分析 由图知在t1时刻V正减小,反应逆向进行,重新平衡时的速率大于原平衡速率,新平衡时反应物浓度比原来还大,结合平衡移动判断.
解答 解:A、t1时减小了A的浓度,增加了C的浓度,平衡向逆反应移动,新平衡时反应物浓度比可以原来还大,平衡时正反应速率可以比原平衡速率大,故A正确;
B、t1升高了温度,平衡向逆反应移动,酸氯增加,且重新平衡时的速率大于原平衡速率,故B错误;
C、t1时增加了A和B的浓度,正反应速率应大于原平衡速率,平衡向正反应方向移动,故C错误;
D、t1时减小了压强,平衡向逆反应方向移动,重新平衡时的速率小于原平衡速率,故D错误;
故选A.
点评 本题考查化学平衡图象、化学平衡移动等,难度中等,根据图象提取信息是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
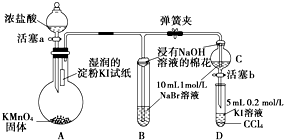 实验题为验证卤素单质氧化性的强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
实验题为验证卤素单质氧化性的强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}I$的化学性质与${\;}_{53}^{127}I$相同 | |
| B. | ${\;}_{53}^{131}I$的原子序数为53 | |
| C. | ${\;}_{53}^{131}I$的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}I$的原子核内中子与质子数之差为25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4分子中N-N键角为109°28′ | |
| C. | N4分子中存在非极性键 | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
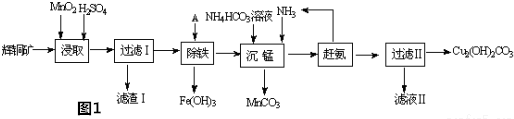

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与AlCl3溶液反应发生的离子方程式为 Al3++3OH-═Al(OH)3↓ | |
| B. | 用HNO3溶液完全中和后,溶液不显中性 | |
| C. | 加水稀释后,溶液中c(NH${\;}_{4}^{+}$)•c(OH-)变大 | |
| D. | 1L0.1mol•L-1的氨水中有6.02×1022个NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4与C4H8一定是同系物 | |
| B. | 丙烯和乙烷都能使高锰酸钾酸性溶液褪色 | |
| C. | 1丁烯与2丁烯互为同分异构体 | |
| D. | 新戊烷和2,2二甲基丙烷互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生产物的总能量有可能相同 | |
| D. | 如果旧化学键断裂吸收的能量大于新化学键形成释放的能量,则该反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com