

 ;
; ;短管进气,便于将饱和食盐水排出;
;短管进气,便于将饱和食盐水排出;

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图①表示催化剂对可逆反应2X(g)+2Y(g)?3Z(g)+W(s)的影响,乙使用催化剂 |
| B、图②可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| C、图③表示1L1mol?L-1FeBr2溶液中通入Cl2时Br-的量的变化 |
| D、图④表示一定浓度NaHCO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(2)(5) |
| B、(5)(6) |
| C、(1)(3) |
| D、(2)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加压 | B、使用催化剂 |
| C、减小C的浓度 | D、降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制的氯水保存在棕色广口瓶中,并放在阴凉处 |
| B、实验室收集NO和NO2时都只能用排空气法 |
| C、烧碱溶液放在带磨口玻璃塞的试剂瓶中 |
| D、保存液溴时应用水进行液封 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①B2H6 |
| ②H2O2/OH- |
 →RCHO+H2O
→RCHO+H2O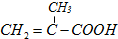 ,经过的反应是
,经过的反应是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com