
已知:O2(g)
= O2+(g)+e-
 H1= +1175.7 kJ·mol-1
H1= +1175.7 kJ·mol-1
PtF6-(g)
=PtF6(g)+e-  H2= +771.1 kJ·mol-1
H2= +771.1 kJ·mol-1
O2+(g)+PtF6-(g)
=O2PtF6(S)  H3= -482.2 kJ·mol-1
H3= -482.2 kJ·mol-1
则反应O2(g)+PtF6(g)
= O2PtF6 (s)的 H是( )
H是( )
A.77.6 kJ B.-77.6 kJ·mol-1 C.+77.6kJ·mol-1 D.-886.8kJ·mol-1
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- ![]() H1=1175.7 kJ·mol-1
H1=1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) ![]() H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) ![]() H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4*)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州市龙湾区龙湾中学高二期中考试化学试卷(带解析) 题型:填空题
(10分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- 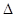 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) 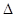 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) 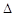 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 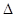 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。
(3)已知:2NO2(g)  N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变);
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的物质的量 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版) 题型:填空题
(8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省高二下二学期期中考试化学试卷 题型:填空题
(9分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”、“向右”或“不”);使用催化剂反应的△H
(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”、“向右”或“不”);使用催化剂反应的△H
(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g)
= O2+(g)+e-
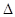 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)
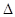 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)
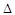 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 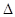 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中
c(NH4+)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com