
����Ŀ������Ӧ����㷺�Ľ����������Ȼ���������Լ������ĺ������ξ�Ϊ��Ҫ�����
��1����ʵ�����У�FeCl2�������ۺ�___(������)��Ӧ�Ʊ���
��2��Fe3O4���ö��ַ����Ƶã�������һ�ֵ��ʺ�һ�ֻ�����ͨ�����Ϸ�Ӧ�Ʊ��Ļ�ѧ����ʽΪ___��
��3��ʵ�������Ʊ�Fe(OH)2ʱ���������������������������___����Ӧ�Ļ�ѧ����ʽΪ___��
��4����ש������������ս���ɵģ����京��Fe2O3�ʺ�ɫ���غ�ɫ���������������������ϡ������һ����ʵ��֤����ש�к���Fe3+��___��
��5������һ����FeCl2��FeCl3�Ļ������Ʒ��ʵ����n(Fe)��n(C1)=1��2.1�������Ʒ��FeCl3�����ʵ�������Ϊ___��
��6���������(K2FeO4)��һ��ǿ������������Ϊˮ��������������ز��ϡ�FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4���䷴Ӧ�����ӷ���ʽΪ��___��
���𰸡�ϡ������Ȼ�����Һ 6FeO+O2![]() 2Fe3O4(��4Fe2O3+Fe
2Fe3O4(��4Fe2O3+Fe![]() 3Fe3O4) ��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ���� 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ����Ʒ���飬��������ݺ�ȡ�ϲ���Һ���μ�KSCN��Һ���Ժ�ɫ 10% 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
3Fe3O4) ��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ���� 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ����Ʒ���飬��������ݺ�ȡ�ϲ���Һ���μ�KSCN��Һ���Ժ�ɫ 10% 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
��������
��1����ʵ�����У�FeCl2�������ۺ����ᷴӦ�Ʊ���Fe+2HCl=FeCl2+H2����
��2��FeO�ڿ����м��ȣ����ɵõ�Fe3O4��Ҳ�����������ۺ�Fe2O3�������Ϸ�Ӧ��ȡFe3O4����ѧ����ʽΪ6FeO+O2![]() 2Fe3O4(��4Fe2O3+Fe
2Fe3O4(��4Fe2O3+Fe![]() 3Fe3O4)��
3Fe3O4)��
��3��Fe(OH)2���ױ������е����������������Ʊ�ʱ������������������ɫ��Fe(OH)2��Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��������ѧ����ʽΪ4Fe(OH)2+O2+2H2O= 4Fe(OH)3��
��4�������ש�к���Fe3+����ʹFe2O3�е�+3����ת��ΪFe3+��Ȼ����KSCN��Һ����Fe3+�������ǽ���Ʒ���飬��������ݺ�ȡ�ϲ���Һ���μ�KSCN��Һ���Ժ�ɫ��
��5����FeCl2��FeCl3�����ʵ����ֱ�Ϊx��y����(x+y)��(2x+3y)= 1��2.1�����x=9y�������Ʒ��FeCl3�����ʵ�������Ϊ10%��
��6��FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4�����Ļ��ϼ����ߣ�����KClO��Cl�Ļ��ϼ۽�������Cl-���䷴Ӧ�����ӷ���ʽΪ��2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O��


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ṥҵ�Ļ�����������Pt���������·�������Ӧ�����Ӧ��
��.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H1=-905 kJ/mol
4NO(g)+6H2O(g) ��H1=-905 kJ/mol
��.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ��H2
2N2(g)+6H2O(g) ��H2
��1����֪��
�����ж���1mol��ѧ����Ҫ������/kJ | NO | O2 | N2 |
629 | 496 | 942 |
���H2=___________��
��2����PtΪ��������1L�ܱ������г���1mol NH3��2mol O2������й����ʵ������¶ȵĹ�ϵ����ͼ��

�ٸô����ڸ���ʱ�Է�Ӧ__________�������������
��520��ʱ��NH3��ת����Ϊ____________��
��520��ʱ����Ӧ���ƽ�ⳣ��K=________�����ּ���ʽ����
������˵����ȷ����____________�����ţ���
A ��ҵ�ϰ�����������NOʱ������¶�Ӧ������840������
B ����NH3��O2�ij�ʼͶ�ϱȿ������NH3����NO��ƽ��ת����
C Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ�ȿ������NH3����NO��ƽ��ת����
D ʹ�ô���ʱ���ɽ��ͷ�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
���¶ȸ���840��ʱ��NO�����ʵ������ٵ�ԭ�������____________��
��3�������������£����ʹ���M�ܴ�NH3��NOx��Ӧ����N2��
��NH3��NO2����N2�ķ�Ӧ�У�������1mol N2ʱ��ת�Ƶĵ�����Ϊ___________mol��
�ڽ�һ��������O2��NH3��NOx�Ļ�����壬����ͨ��װ�д����ķ�Ӧ���з�Ӧ��
��Ӧ��ͬʱ��NOx��ȥ�����淴Ӧ�¶ȵı仯��������ͼ��ʾ����50-250�淶Χ�������¶ȵ����ߣ�NOx��ȥ������Ѹ��������������������Ҫԭ����_______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ksp(CuS)��6.0��10��36��Ksp(ZnS)��3.0��10��25��Ksp(PbS)��9.0��10��29������Ȼ���У���п��(ZnS)�ͷ�Ǧ��(PbS)��CuSO4��Һ��ת����ͭ��(CuS)�������й�˵������ȷ����(����)
A. ZnSת����ͭ�������ӷ���ʽΪZnS(s)��Cu2��(aq) ![]() Zn2��(aq)��CuS(s)
Zn2��(aq)��CuS(s)
B. ��ˮ�е��ܽ�ȣ�S(ZnS)>S(PbS)>S(CuS)
C. ����Һ��c(Cu2��)��1��10��10 mol��L��1����S2������ȫת����CuS
D. �ڰ�ɫZnS��Һ�еμ�Pb(NO3)2��Һ���������ɺ�ɫ����(PbS)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2A��g��B��g�����ֱ�ȡ1molA��2L�Ĺ̶�����������У��ֱ���T1��T2�£����A��ת������ʱ��仯�Ĺ�ϵ������ͼ��ʾ������˵����ȷ����
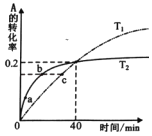
A.�����¶ȿ����̷�Ӧ����ƽ���ʱ��ͬʱ�����Aƽ���ת����
B.�ӷ�Ӧ��ʼ��40minʱ��T2�¶�������B�����ʵ�����T1�¶��¶�
C.ͼ��a��b��c����Ļ�ѧ��Ӧ�������μ�С
D.��B��ʾT1�¶���ǰ40min��ƽ����Ӧ���ʣ�v(B)��0.0025molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��BΪԭ�Ϻϳɱ�����������F��·����ͼ��ʾ��
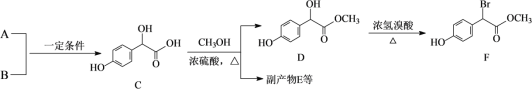
��1��A����ʽΪC2H2O3���ɷ���������Ӧ���Ҿ������ԣ�A��������������Ϊ__________��
��2��A+BC�ķ�Ӧ����Ϊ_______��A��ˮ��Һ����������������ͭ����Һ����,��Ӧ�Ļ�ѧ����ʽΪ_______��C(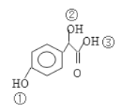 )������̼ԭ�������ӵ��ǻ��ڢ٢ڢ���������_______���ǿ������������
)������̼ԭ�������ӵ��ǻ��ڢ٢ڢ���������_______���ǿ������������
��3��B�����������_______��ԭ�ӹ��棬��B��ˮ��Һ�еμ�Ũ��ˮ������_______��F�ڼ���������������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ_______��
��4��E����2����C���ɵĺ���3����Ԫ���Ļ����E���ӵĽṹ��ʽΪ_______��
��5���ڷ�������������F��ͬ���칹��(�����������칹)�У��˴Ź������������������ʵĽṹ��ʽΪ____________
������һԪ�������ڱ�����ֻ��2��ȡ�����Ҵ��ڶ�λ������һ�����ǻ���
��6����֪��![]() ��A�ж��ֺϳɷ������ڷ�����д��������ϳ�A��·������ͼ(����ԭ����ѡ)��_______
��A�ж��ֺϳɷ������ڷ�����д��������ϳ�A��·������ͼ(����ԭ����ѡ)��_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��Fulvio Cacace���˻���˼��������о������N4������ӡ�N4���ӽṹ��ͼ��ʾ������˵����ȷ���� (����)
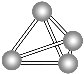
A. N4��N2��Ϊͬ���칹��
B. N4������ֻ���й��ۼ�
C. 1 mol N4�����������ۼ���Ϊ4NA
D. N4��P4(����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2 �ĵ���Դ�������ǽ������ЧӦ����Ҫ;������������һ���������� NH3���� CO2������Ҫ������Ʒ��������ķ�Ӧ��NH3+CO2�� +H2O�������й����������˵����ȷ���ǣ� ��
+H2O�������й����������˵����ȷ���ǣ� ��
A.C��N��O ԭ�Ӳ�����ͬ���ӻ���ʽB.�����мȺ����Լ����ֺ��Ǽ��Լ�
C.����ʽΪC3H3N3O3D.���ɸ����ʵ�������ӦΪ�кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˫���ű�ʾ���з�Ӧ�ĵ���ת�Ʒ������Ŀ��
��Cu��4HNO3(Ũ)===Cu(NO3)2��2NO2����2H2O__________
��3Cl2��6KOH===5KCl��KClO3��3H2O_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CH3OCH3)����Ϊ21���͵�����ȼ�ϣ���CO��H2Ϊԭ��������������Ҫ��������������Ӧ��
��1���ù��յ��ܷ�ӦΪ3CO(g)��3H2(g)![]() CH3OCH3(g)��CO2(g) ��H��_________����ѧƽ�ⳣ��K��______________(�ú�K1��K2��K3�Ĵ���ʽ��ʾ)��
CH3OCH3(g)��CO2(g) ��H��_________����ѧƽ�ⳣ��K��______________(�ú�K1��K2��K3�Ĵ���ʽ��ʾ)��
��ѧ��Ӧ����ʽ | ��ѧƽ�ⳣ�� | |
��CO(g)��2H2(g) | ��H1=-99 kJmol-1 | K1 |
��2CH3OH(g) | ��H2����24 kJmol-1 | K2 |
��CO(g)��H2O(g) | ��H3����41 kJmol-1 | K3 |
��2��ij�¶��£���8.0molH2��4.0molCO�����ݻ�Ϊ2L���ܱ������У�������Ӧ��4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g)��10 ���Ӻ�Ӧ��ƽ�⣬��ö����ѵ��������Ϊ25%������H2��ʾ�ķ�Ӧ����Ϊ_________��CO��ת����Ϊ________��
CH3OCH3(g)+H2O(g)��10 ���Ӻ�Ӧ��ƽ�⣬��ö����ѵ��������Ϊ25%������H2��ʾ�ķ�Ӧ����Ϊ_________��CO��ת����Ϊ________��
��3�����д�ʩ�У������CH3OCH3���ʵ���________��
A������������� B�������¶� C�����ø�Ч����D������ѹǿ
��4���ù����з�Ӧ�۵ķ��������CH3OCH3�IJ��ʣ�ԭ����________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com