
 科学研究发现Cu2O可作为太阳光分解水的催化剂.
科学研究发现Cu2O可作为太阳光分解水的催化剂.
| ||
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
| ||
| ||
| 0.0010mol | ||
|


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、电解饱和食盐水:2Cl-+H2O═2OH-+H2↑+Cl2↑ |
| C、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 |
| B、人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
| C、大量燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,从而使雨水pH=5.6形成酸雨 |
| D、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
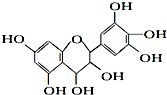
| A、该物质既可看作醇类,也可看作酚类 |
| B、1mol该物质可与4mol Br2反应 |
| C、1mol该物质可与7mol Na反应 |
| D、1mol该物质可与7mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| B、做衣服的棉和麻均与淀粉互为同分异构体 |
| C、制饭勺、饭盒、高压锅等的不锈钢是合金 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始浓度(mol.L-l) | c(NH3) | c(O2) | c(NO) | c(H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①常用于分离互不相溶的液体 |
| B、装置②可用于实验室加热酒精与浓硫酸的混合物制取乙烯 |
| C、装置③可用于制备乙酸乙酯 |
| D、装置④可用于收集NO、CO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.
前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com