
| A、在碳酸氢钠溶液中加入盐酸:HCO3-+H+=CO2↑+H2O |
| B、把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| C、向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- |
| D、钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |


科目:高中化学 来源: 题型:
| A、BaSO4、BaCO3都难溶于水,在医学上均可用作“钡餐” |
| B、用浸泡过高锰酸钾溶液的硅藻土保护水源 |
| C、明矾水解时产生具有吸附性的胶体粒子,可用作漂白粉 |
| D、棉花、蛋白质和油脂都是高分子化合物,水解产物均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
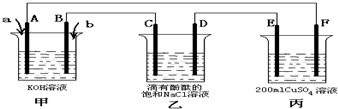
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素X的简单氢化物的沸点<元素W的简单氢化物的沸点 |
| B、元素W的最高价氧化物对应水化物的酸性比Z的弱 |
| C、化合物YX、ZX2、WX3中化学键的类型相同 |
| D、原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:
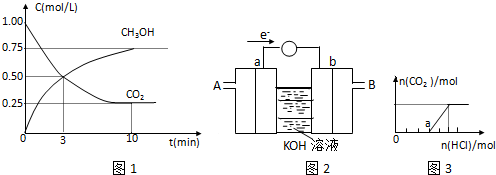
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
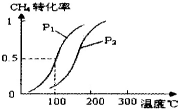 甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.
甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | ||
| 1 | 150 |
| 0.1 | ||
| 2 |
| 5 | |||
| 3 | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HCN>HClO |
| B、浓度:c(CN-)<c(ClO-) |
| C、pH:HClO>HCN |
| D、与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com