
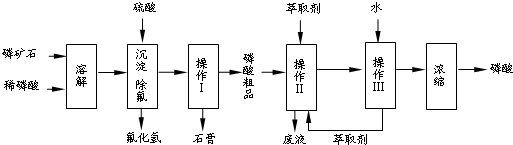
分析 磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质,磷矿石加入稀磷酸溶解生成磷酸二氢钙和氟化氢,加入硫酸沉淀除除氟,过滤得到彻底石膏,滤液为磷酸粗品,磷酸粗品中含有H+、Ca2+、Mg2+、Fe3+离子,加入萃取剂萃取,分液后再加入水反萃取,用来除去磷酸粗品中的杂质Mg2+、Fe3+等,得到溶液浓缩得到较纯净的磷酸;
(1)操作Ⅰ通过过滤分离出石膏,根据图示,磷酸粗品中含有H+、Ca2+、Mg2+、Fe3+离子,操作Ⅱ、Ⅲ是萃取和反萃取,用来除去磷酸粗品中的杂质Mg2+、Fe3+等;
(2)HF具有腐蚀性,能够腐蚀玻璃,不能使用玻璃仪器溶解磷矿石;
(3)直接用硫酸溶解磷矿石,生成的石膏会沉积在磷矿石表面;
(3)根据萃取操作用到的仪器完成;根据萃取操作中对萃取剂要求分析;
(4)定量仪器是准确量取溶液的滴定管,配制1L溶液的容量瓶;
(5)相对误差=$\frac{计算值-测量值}{测量值}$,根据生成产物NaH2PO4和氢氧化钠的关系式及滴定数据,计算出磷酸产品的质量分数.
解答 解:(1)操作Ⅰ通过过滤分离出石膏,根据图示,磷酸粗品中含有H+、Ca2+、Mg2+、Fe3+离子,操作Ⅱ、Ⅲ是萃取和反萃取,萃取时,必须满足萃取剂与水互不相溶、萃取的物质在水中的溶解度较小,工艺流程中设计操作Ⅱ与Ⅲ的目的是用来除去磷酸粗品中的杂质Mg2+、Fe3+等;
故答案为:过滤;萃取;除去磷酸粗品中的杂质Mg2+、Fe3+等;
(2)若在实验室里采用此种方法溶解磷矿石,由于HF具有腐蚀性,能够腐蚀玻璃,所以不能使用玻璃仪器,或要在密闭系统中进行,因为HF有剧毒,
故答案为:不能使用玻璃器皿,因为HF会腐蚀玻璃或要在密闭系统中进行,因为HF有剧毒;
(3)如果直接用硫酸溶解磷矿石,生成的石膏会沉积在磷矿石表面,该工艺避免了生成的石膏沉积在磷矿石表面,
故答案为:避免生成的石膏沉积在磷矿石表面;
(4)准确量取10.00mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103mol/L标准NaOH溶液滴定,该实验过程中需要的定量仪器有准确量取溶液的滴定管,配制溶液所需的1000mL的容量瓶;
故答案为:滴定管、1000mL容量瓶;
(5)相对误差=$\frac{计算值-测量值}{测量值}$×100%=$\frac{20.16-20.20}{20.20}$×100%=-0.2%,
磷酸产品的质量是:10.00mL×1.526g/cm3=15.26g,1L磷酸产品配成的溶液消耗0.103mol/L标准NaOH溶液的体积为:20.16mL×$\frac{1000}{20}$=1.008L,
磷酸与氢氧化钠反应的关系式为:H3PO4~NaH2PO4~NaOH,n(H3PO4)=n(NaOH)=0.103mol/L×1.008L≈0.1040mol,
所以该磷酸产品的质量分数为:$\frac{98g/mol×0.1040mol}{1.526g/c{m}^{3}×10ml}$×100%≈66.7%,
故答案为:-0.2%;66.7%.
点评 本题通过工业上以磷矿石为原料制备H3PO4的常用方法,充分考查了实验分析及实验操作知识,流程分析判断,物质性质和实验基本操作的理解应用,注意绝对误差和质量分数的计算应用,本题难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层电子排布不一定都是以p6结束 | |
| B. | 化学性质非常不活泼 | |
| C. | 其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式 | |
| D. | 原子半径比同周期ⅦA族元素原子的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  NaOH溶液 | B. |  稀硫酸 | C. |  稀硝酸 | D. |  稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1molN2和3mol H2充分反应,生成物中的 N-H键的数目为6NA | |
| B. | 23g NO2和 N2O4的混合物中原子总数为1.5NA | |
| C. | 1L 0.1mol•L-1的Na2S溶液中S2- 与 HS- 的总数为0.1NA | |
| D. | 向FeI2溶液中通入适量的氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | C(HCL)(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-1-2 | B. | 1-2-4-3 | C. | 4-2-3-1 | D. | 4-3-2-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2 C6H5ONa+H2O+CO2→2 C6H5OH+Na2CO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| C. | C6H5OH+Na2CO3→C6H5ONa+NaHCO3 | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com