
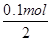 ×2=0.1mol。
×2=0.1mol。

科目:高中化学 来源:不详 题型:单选题
 Ag2O+Zn+2H2O,此电池放电时,负极上发生反应的物质是( )
Ag2O+Zn+2H2O,此电池放电时,负极上发生反应的物质是( )| A.Ag | B.Zn(OH)2 | C.Ag2O | D.Zn |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4在负极发生氧化反应 |
| B.O2作为氧化剂发生还原反应 |
| C.甲烷燃料电池实现了化学能转变为电能 |
| D.分别将1molH2和CH4做燃料电池的原料,产生电量一样多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正极的电极反应可能是O2+4e-+2H2O→4OH- |
| B.负极的电极反应可能是O2+4e-+2H2O→4OH- |
| C.负极的反应主要是C6H12O6(葡萄糖)被还原生成CO2或HCO3- |
| D.正极的反应主要是C6H12O6(葡萄糖)被氧化生成CO2或HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
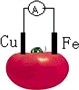
| A.铜片为负极 |
| B.铁片上发生还原反应 |
| C.该装置将电能转变为化学能 |
| D.电子由铁片沿导线流向铜极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用后不能再生的电池称为一次电池,如锌锰干电池(电解质溶液中含氯化铵等) |
| B.放电后通过充电可反复使用的电池称为二次电池,如镍镉电池、铅蓄电池等 |
| C.手机、电脑、数码相机中的可充电电池使用寿命长,对环境无害,不用进行回收 |
| D.目前我国生产的无汞干电池,对环境和人体健康没有明显危害,可以不进行特殊处理,和普通垃圾混放 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.负极反应式为CH4+10OH--8e=CO32-+7H2O |
| B.正极反应式为O2+2H2O+4e=4OH- |
| C.随着不断放电,电解质溶液碱性不变 |
| D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
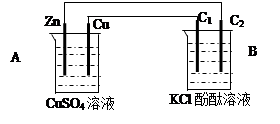
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
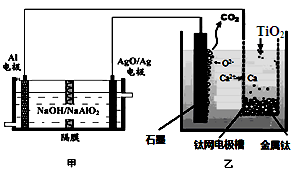
| A.乙装置阴极的电极反应式为 TiO2+4e-=Ti+2O2- |
| B.若不考虑能量的损失,制备24.0g 金属钛,需要消耗金属铝36.0g |
| C.甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动 |
| D.乙装置中的石墨电极需要定期更换 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com