
 CH3OH(g)+H2O(g) ¦¤H=£49.0 mol”¤L-1£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
CH3OH(g)+H2O(g) ¦¤H=£49.0 mol”¤L-1£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£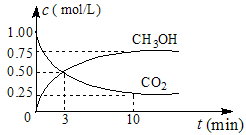
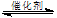 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g) 
 2CO(g)µÄĘ½ŗā³£ŹżK£½1.64£¬ĻąĶ¬Ģõ¼žĻĀ²āµĆc(CO)£½0.20 mol”¤L£1”¢c(CO2)£½0.05 mol”¤L£1£¬“ĖŹ±·“Ó¦Ļņ £ØĢī”°Õż”±»ņ”°Äę”±£©·½Ļņ½ųŠŠ”£
2CO(g)µÄĘ½ŗā³£ŹżK£½1.64£¬ĻąĶ¬Ģõ¼žĻĀ²āµĆc(CO)£½0.20 mol”¤L£1”¢c(CO2)£½0.05 mol”¤L£1£¬“ĖŹ±·“Ó¦Ļņ £ØĢī”°Õż”±»ņ”°Äę”±£©·½Ļņ½ųŠŠ”£ CO(g)+H2O(g) ”÷H> 0·“Ó¦£¬µ±·“Ó¦“ļµ½Ę½ŗāŗó£¬ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬ČōÉżøßĪĀ¶Č£¬ĒėŌŚĻĀĶ¼ÖŠ»³öÕż(vÕż)”¢Äę(vÄę)·“Ó¦ĖŁĀŹĖꏱ¼ät±ä»ÆµÄŹ¾ŅāĶ¼”£
CO(g)+H2O(g) ”÷H> 0·“Ó¦£¬µ±·“Ó¦“ļµ½Ę½ŗāŗó£¬ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬ČōÉżøßĪĀ¶Č£¬ĒėŌŚĻĀĶ¼ÖŠ»³öÕż(vÕż)”¢Äę(vÄę)·“Ó¦ĖŁĀŹĖꏱ¼ät±ä»ÆµÄŹ¾ŅāĶ¼”£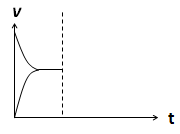
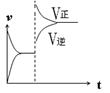
 ӣ
”£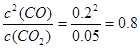 £¼1.64£¬ĖłŅŌ·“Ó¦ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ”£
£¼1.64£¬ĖłŅŌ·“Ó¦ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ”£

 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 C(g)£«D(g),5 minŗó“ļµ½Ę½ŗā£®ŅŃÖŖøĆĪĀ¶ČĻĀĘäĘ½ŗā³£ŹżK£½1£¬ČōĪĀ¶Č²»±äŹ±½«ČŻĘ÷µÄĢå»żĄ©“óĪŖŌĄ“µÄ10±¶£¬AµÄ×Ŗ»ÆĀŹ²»·¢Éś±ä»Æ£¬Ōņ
C(g)£«D(g),5 minŗó“ļµ½Ę½ŗā£®ŅŃÖŖøĆĪĀ¶ČĻĀĘäĘ½ŗā³£ŹżK£½1£¬ČōĪĀ¶Č²»±äŹ±½«ČŻĘ÷µÄĢå»żĄ©“óĪŖŌĄ“µÄ10±¶£¬AµÄ×Ŗ»ÆĀŹ²»·¢Éś±ä»Æ£¬Ōņ| A£®a£½3 | B£®a£½2 | C£®BµÄ×Ŗ»ÆĀŹĪŖ40% | D£®BµÄ×Ŗ»ÆĀŹĪŖ60% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2C(g)£¬ĻĀĮŠĒéæöÄÜĖµĆ÷øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ£Ø £©
2C(g)£¬ĻĀĮŠĒéæöÄÜĖµĆ÷øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ£Ø £©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 Y(g)+Z (s)£¬ŅŌĻĀÄÜĖµĆ÷×÷ĪŖ·“Ó¦“ļµ½Ę½ŗā±źÖ¾µÄŹĒ ( )
Y(g)+Z (s)£¬ŅŌĻĀÄÜĖµĆ÷×÷ĪŖ·“Ó¦“ļµ½Ę½ŗā±źÖ¾µÄŹĒ ( ) | A£®XµÄ·Ö½āĖŁĀŹÓėYµÄĻūŗÄĖŁĀŹĻąµČ | B£®X”¢YÓėZµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1£ŗ1 |
| C£®»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ±ä»Æ | D£®µ„Ī»Ź±¼äÄŚÉś³ÉlmolYµÄĶ¬Ź±·Ö½ā2mol X |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 CH3OH(g) ¦¤H£½£90.7 kJ/mol)£ŗ
CH3OH(g) ¦¤H£½£90.7 kJ/mol)£ŗ| ČŻĘ÷ | ¼× | ŅŅ | ±ū |
| ·“Ó¦ĪļĶ¶ČėĮæ | 1 mol CO”¢2 mol H2 | 1 mol CH3OH | 2 mol CH3OH |
| CH3OHµÄÅضČ(mol/L) | c1 | c2 | c3 |
| ·“Ó¦µÄÄÜĮæ±ä»Æ | ·Å³öa kJ | ĪüŹÕb kJ | ĪüŹÕc kJ |
| Ę½ŗāŹ±Ń¹Ēæ(Pa) | P1 | P2 | P3 |
| ·“Ó¦Īļ×Ŗ»ÆĀŹ | ¦Į1 | ¦Į2 | ¦Į3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2Z ”÷H< 0“ļµ½Ę½ŗāŹ±£¬ČōÉżøßĪĀ¶ČŌņÄÜŹ¹
2Z ”÷H< 0“ļµ½Ę½ŗāŹ±£¬ČōÉżøßĪĀ¶ČŌņÄÜŹ¹| A£®ZµÄÖŹĮæ·ÖŹżŌö“ó |
| B£®XµÄ×Ŗ»ÆĀŹŌö“ó£¬YµÄ×Ŗ»ÆĀŹ¼õŠ” |
| C£®XµÄ×Ŗ»ÆĀŹ¼õŠ”£¬YµÄ×Ŗ»ÆĀŹŌö“ó |
| D£®YµÄÖŹĮæ·ÖŹżŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 cC(s)£«dD(g)“ļµ½Ę½ŗāŹ±£¬Ęä·“Ó¦µÄKÖµÓėĪĀ¶ČÓŠ¹Ų”£ĒėŠ“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½
cC(s)£«dD(g)“ļµ½Ę½ŗāŹ±£¬Ęä·“Ó¦µÄKÖµÓėĪĀ¶ČÓŠ¹Ų”£ĒėŠ“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½  CO2(g)£«H2(g)””¦¤H<0”£ŌŚ850 ”ꏱ£¬K£½1”£
CO2(g)£«H2(g)””¦¤H<0”£ŌŚ850 ”ꏱ£¬K£½1”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

| A£®X”¢Y”¢ZµÄ·“Ó¦ĖŁĀŹĻąµČ | B£®X”¢YµÄ·“Ó¦ĖŁĀŹ±ČĪŖ2£ŗ3 |
| C£®ČŻĘ÷ÄŚĘųĢåŃ¹Ēæ±£³Ö²»±ä | D£®Éś³É1molZµÄĶ¬Ź±Éś³É2molX |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2HI£Øg£©µÄĘ½ŗā³£ŹżK="O.25" £¬øĆĪĀ¶ČĻĀŌŚ¼×”¢ŅŅ”¢±ūČżøöŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėH2 (g)”¢ I2 (g)£¬ĘšŹ¼ÅضČČēĻĀ±ķĖłŹ¾£ŗ
2HI£Øg£©µÄĘ½ŗā³£ŹżK="O.25" £¬øĆĪĀ¶ČĻĀŌŚ¼×”¢ŅŅ”¢±ūČżøöŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėH2 (g)”¢ I2 (g)£¬ĘšŹ¼ÅضČČēĻĀ±ķĖłŹ¾£ŗ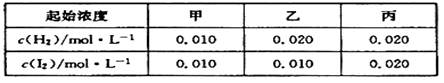
| A£®Ę½ŗāŹ±¼×ÖŠŗĶ±ūÖŠH2µÄ×Ŗ»ÆĀŹĻąĶ¬ |
| B£®Ę½ŗāŹ±ŅŅÖŠI2µÄ×Ŗ»ÆĀŹŠ”ÓŚ40% |
| C£®Ę½ŗāŹ±ŅŅÖŠc(HI)±Č¼×ÖŠµÄ2±¶“ó |
| D£®·“Ó¦Ę½ŗāŹ±,±ūÖŠĘųĢåŃÕÉ«×īÉī£¬ŅŅÖŠĘųĢåŃÕÉ«×īĒ³ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com