
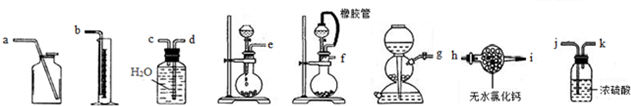
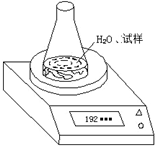
| 锥形瓶+水+试样 | |||||
| 读数次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 质量/g | 192.80 | 192.30 | 192.10 | 192.00 | 192.00 |
分析 (1)测定CaC2试样的纯度,可以利用碳化钙和食盐水发生反应生成乙炔,乙炔不溶于水,可以用排水量气法测定生成乙炔的体积,据此计算碳化钙的质量得到试样的纯度;若实验时称取的试样为 m g,产生的乙炔在标准状况下的体积为n mL,结合化学方程式定量关系计算碳化钙物质的量,得到碳化钙质量计算纯度,碳化钙纯度=$\frac{碳化钙质量}{试样质量}$×100%;
(2)①不必作第六次读数的原因是图表数据中固体质量恒重时说明称量准确;
②有同学认为用此装置测得的数据比真实值小,产生误差的原因是水蒸气可能随气体挥出;
③增加一个吸收水蒸气的干燥装置,使结果更加准确;
(3)含CaO杂质的CaC2试样,取20mL定容后的溶液,称取6.80g试样,用200mL 1.85mol/L的稀盐酸溶解,将所得的溶液转移至500mL容量瓶中,定容,取20mL定容后的溶液用0.20mol/L的NaOH溶液滴定至终点,消耗NaOH溶液30.00mL,计算剩余盐酸溶液中HCl的物质的量,换算500ml溶液中剩余HCl物质的量,得到与碳化钙反应的盐酸物质的量,结合化学方程式定量关系和钙元素守恒计算得到碳化钙物质的量得到质量.
解答 解:(1)测定CaC2试样的纯度,可以利用碳化钙和食盐水发生反应生成乙炔,乙炔不溶于水,可以用排水量气法测定生成乙炔的体积,据此计算碳化钙的质量得到试样的纯度,利用装置生成乙炔,导气管短进长出通过排水法把水排到量筒中读取生成气体在标准状况下的体积,所以接口为fcdb;若实验时称取的试样为 m g,产生的乙炔在标准状况下的体积为n mL,结合化学方程式定量关系计算碳化钙物质的量,
CaC2+2H2O→Ca(OH)2+C2H2↑,
1 1
n(CaC2) $\frac{n×1{0}^{-3}}{22.4}$mol
n(CaC2)=$\frac{n×1{0}^{-3}}{22.4}$mol,
得到碳化钙质量计算纯度,碳化钙纯度=$\frac{碳化钙质量}{试样质量}$×100%=$\frac{\frac{n×1{0}^{-3}}{22.4}mol×64g/mol}{mg}$×100%=$\frac{64n}{22400m}$×100%,
故答案为:$\frac{64n}{22400m}$×100%;
(2)①不必作第六次读数的原因是图表数据中固体质量恒重时说明称量准确,第4、5次试验读数相同,表明锥形瓶内质量已达恒定反应进行完全,
故答案为:第4、5次试验读数相同,表明锥形瓶内质量已达恒定反应进行完全;
②有同学认为用此装置测得的数据比真实值小,产生误差的原因是水蒸气可能随气体挥出,导致质量差减小,计算得到碳化钙质量减小,
故答案为:水蒸气随C2H2挥发;
③增加一个吸收水蒸气的干燥装置,使结果更加准确,在锥形瓶口添加一个带有无水氯化钙的干燥管的单孔橡皮塞,
故答案为:在锥形瓶口添加一个带有无水氯化钙的干燥管的单孔橡皮塞;
(3)含CaO杂质的CaC2试样,取20mL定容后的溶液,称取6.80g试样,用200mL 1.85mol/L的稀盐酸溶解,发生的反应为CaO+2HCl=CaCl2+H2O,CaC2+2HCl=CaCl2+C2H2,将所得的溶液转移至500mL容量瓶中,定容,取20mL定容后的溶液,用0.20mol/L的NaOH溶液滴定至终点,消耗NaOH溶液30.00mL,计算剩余盐酸溶液中HCl的物质的量=0.030L×0.20mol/L=0.006mol,换算500ml溶液中剩余HCl物质的量=0.006mol×$\frac{500}{20}$=0.15mol,得到与碳化钙反应的盐酸物质的量=0.2L×1.85mol/L-0.15mol=0.22mol,设样品中氧化钙物质的量为x,碳化钙物质的量为y,则
56x+64y=6.8
2x+2y=0.22
x=0.03mol
y=0.08mol
则6.80g试样中CaC2的质量=0.08mol×64g/mol=5.12g,
故答案为:5.12.
点评 本题考查学生对的实验方案原理的理解与评价、物质组成含量的测定、化学计算等,题目难度中等,理清实验原理是关键,是对学生综合能力想考查,需要学生具备扎实的基础知识.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
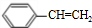 +Br2→
+Br2→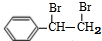
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X),离子半径大小顺序:r(Z2-)>r(W+) | |
| B. | 元素Y的简单气态氢化物的热稳定性和熔沸点都比Z的高 | |
| C. | 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 | |
| D. | 化合物X2Z2与W2Z2所含化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
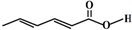 ,下列关于山梨酸的说法错误的是( )
,下列关于山梨酸的说法错误的是( )| A. | 分子式为C7H8O2 | |
| B. | 1mol该物质最多可与2mol Br2发生加成反应 | |
| C. | 可使酸性KMnO4溶液褪色 | |
| D. | 可与醇发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 原子半径:Z>X>Y | |
| B. | Y的最高正价与最低负价的和是4 | |
| C. | W的单质是工业制取盐酸的原料之一 | |
| D. | X、W的氢化物相遇会产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浮物由黑色变为白色,因SO2是一种漂白剂 | |
| B. | 悬浮物由黑色变为白色,因为形成了PbSO4 | |
| C. | 有黄色沉淀生成 | |
| D. | 有臭鸡蛋味的气体放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com