
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
 NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,[H2]=0.5 mol·L-1,[HI]=4 mol·L-1,则此温度下反应①的平衡常数为( )
A.9 mol2·L-2 B.16 mol2·L-2 C.20 mol2·L-2 D.25 mol2·L-2
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2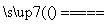
 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
A.方框中的物质应为Cu2S
B.该反应的部分产物可用于硫酸工业
C.反应中SO2既是氧化产物又是还原产物
D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于酯类说法正确的是( )
A.乙酸乙酯和甲醛最简式相同
B.酯类都能发生水解反应
C.酯在酸性条件下水解程度比在碱性条件下大
D.只有有机酸和醇才能反应生成酯
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A.开始加入合金的质量可能为16.4 g
B.参加反应的硝酸的物质的量为0.1 mol
C.生成沉淀完全时消耗NaOH溶液的体积为100 mL
D.标准状况下产物NO的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应中,平衡常数与反应进行的限度的关系正确的是( )
A.K越大,反应程度越大
B.K越大,反应程度越小
C.K的大小与反应程度无关
D.升高温度,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)
 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)
 2H2O(g),
2H2O(g),
K=2×1081 mol-1·L;
③2CO2(g)
 2CO(g)+O2(g),K=4×10-92 mol·L-1
2CO(g)+O2(g),K=4×10-92 mol·L-1
则常温下,NO、H2O、CO2这三种化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为( )
A.3 mL B.7.5 mL C.15 mL D.17.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)[2014·江苏,17(4)]
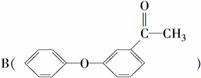 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对碱性锌锰电池的叙述不正确的是( )
A.Zn是正极,MnO2是负极
B.电解质是KOH溶液
C.Zn发生氧化反应,MnO2发生还原反应
D.它的能量和储存时间比普通锌锰电池高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com