
第三周期元素形成的单质中,属于原子晶体的是( )
A.金刚砂 B.金刚石? C.单晶硅 D.二氧化碳
科目:高中化学 来源: 题型:
 (2011?金台区模拟)(物质结构与性质)有A?B?C?D?E?F六种元素,除E为第4周期元素外其余均为短周期元素,且A?B?C?F?D?E原子序数依次增大.A?E位于元素周期表的s区,其余元素位于p区,A?E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的一种单质易自燃;F的基态原子核外成对电子数是成单电子数的3倍?回答下列问题:
(2011?金台区模拟)(物质结构与性质)有A?B?C?D?E?F六种元素,除E为第4周期元素外其余均为短周期元素,且A?B?C?F?D?E原子序数依次增大.A?E位于元素周期表的s区,其余元素位于p区,A?E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的一种单质易自燃;F的基态原子核外成对电子数是成单电子数的3倍?回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
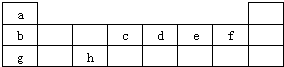 (2010?普陀区二模)如图是元素周期表的前三周期.请用相应的化学用语回答下列问题:
(2010?普陀区二模)如图是元素周期表的前三周期.请用相应的化学用语回答下列问题:


查看答案和解析>>
科目:高中化学 来源:黑龙江省哈师大附中2011-2012学年高一4月月考化学试题 题型:022
下表是元素周期表的一部分,针对表中的①~⑦种元素,填写下列空白:

(1)③和⑧的氢化物沸点高的是________(填化学式),原因是________.
(2)第三周期的元素形成的单原子离子半径最大的是________(填化学式).
(3)①和②按质量比3:8形成的化合物A的电子式为________,将过量A通入由②和⑤形成的阴离子的盐溶液的的离子方程式为________.
(4)用电子式表示元素④与⑦的化合物的形成过程:________,该化合物属于________(填“共价”或“离子”)化合物.
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分, 针对表中的① ~ ⑦种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③和⑧的氢化物沸点高的是 (填化学式),原因是 。
(2)第三周期的元素形成的单原子离子半径最大的是 (填化学式)。
(3)①和②按质量比3:8形成的化合物A的电子式为 ,将过量A通入由②和⑤形成的阴离子的盐溶液的的离子方程式为 。
(4)用电子式表示元素④与⑦的化合物的形成过程: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com