
| A. | Cl2 HBr HCl H2 | B. | Cl2 HCl HBr H2 | C. | H2HBr HCl Cl2 | D. | H2 HCl HBr Cl2 |
分析 A和D两瓶气体混合后见光爆炸,可知A和D为氯气和氢气;A和B两瓶气体混合后,瓶壁上出现暗红色小液滴,氢气与氯化氢、溴化氢不发生反应,所以A只能是氯气,D为氢气,根据能够与氯气反应推断出B,剩下的就是D.
解答 解:在A、B、C、D四个集气瓶中盛有H2、Cl2、HCl、HBr中的任一种气体;若将A和D两瓶气体混合后见光爆炸,说明A、D中的气体为氢气和氯气;若将A和B两瓶气体混合后,瓶壁上出现暗红色小液滴,由于氢气不能够与HCl、HBr反应,而氯气能够与溴化氢反应生成溴单质,所以A为氯气、D为氢气、B为溴化氢,剩下的为C氯化氢,即A、B、C、D四个集气瓶中分别盛放的气体是:Cl2、HBr、HCl、H2,
故选A.
点评 本题考查物质的检验与鉴别,该题是高考中的常见题型,属于中等难度的试题,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.该类试题需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可.


科目:高中化学 来源: 题型:选择题
| A. | 46 g C2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含电子总数为9NA | |
| C. | 标准状况下,11.2 L CO2和乙炔的混合气体所含π键数目为NA | |
| D. | CO2气体与足量的Na2O2反应,固体增重28 g时转移了NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
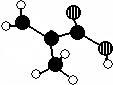 化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl具有很强的酸性,所以氯元素的非金属性很强 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 | |
| C. | 1.12LCl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{15}^{30}P$→${\;}_{14}^{30}Si$+x | B. | ${\;}_{7}^{14}N{+}_{0}^{1}n$→${\;}_{6}^{14}C$+x | ||
| C. | ${\;}_{27}^{60}Co$→${\;}_{28}^{60}Ni$+x | D. | ${\;}_{13}^{27}Al{+}_{2}^{4}He$→${\;}_{15}^{30}P$+x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| B. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| C. | 在反应SO2+2H2S═3S+2H2O中SO2作氧化剂 | |
| D. | 硫粉在过量的纯氧中燃烧可以生成SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com