
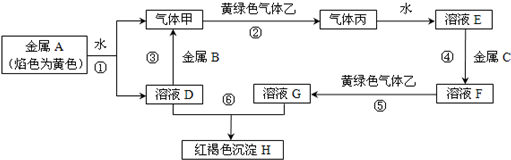
分析 金属单质A焰色反应为黄色,故A为Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;B是地壳中含量最多的金属,氢氧化钠与金属B反应生成氢气,故金属B为Al,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应生成F,F与氯气反应生成G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,据此解答.
解答 解:金属单质A焰色反应为黄色,故A为Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;B是地壳中含量最多的金属,氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应生成F,F与氯气反应生成G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)根据上面的分析可知,丙为HCl,故答案为:HCl;
(2)反应③的离子方程式:2OH-+2H2O+2Al═2AlO2-+3H2↑,反应⑤的离子方程式:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2OH-+2H2O+2Al═2AlO2-+3H2↑; 2Fe2++Cl2=2Fe3++2Cl-;
(3)C为Fe,金属C在一定条件下与水蒸气反应的化学方程式为 3Fe+4H2O(g)═Fe3O4+4H2 ,
故答案为:3Fe+4H2O(g)═Fe3O4+4H2 ;
(4)F为FeCl2,溶液F中加入溶液D后的现象是先出现白色沉淀,迅速转化为灰绿色沉淀,最后转化为红褐色沉淀,所发生反应的化学方程式为 FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:先出现白色沉淀,迅速转化为灰绿色沉淀,最后转化为红褐色沉淀;FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(5)F为FeCl2,溶液F放置于空气中容易变质生成铁离子,检验溶液F是否变质的方法是取少量溶液于试管中,滴加几滴硫氰化钾溶液,若溶液变红,则证明溶液F已经变质,
故答案为:取少量溶液于试管中,滴加几滴硫氰化钾溶液,若溶液变红,则证明溶液F已经变质.
点评 本题考查无机物的推断,题目难度中等,需要学生熟练掌握元素化合物知识,特殊的颜色与特殊反应是推断的突破口.


科目:高中化学 来源: 题型:解答题
 有可逆反应A(g)+B(g)?xC(g)+D(g),某温度时,在固定容积为2L的密闭容器内充入一定量的A、B,并保持温度不变.A、B、C、D物质的量随时间的变化如图所示:
有可逆反应A(g)+B(g)?xC(g)+D(g),某温度时,在固定容积为2L的密闭容器内充入一定量的A、B,并保持温度不变.A、B、C、D物质的量随时间的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热,用湿润的红色石蕊试纸在试管口观察现象 | |
| B. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| C. | 加强碱溶液,加热,滴入酚酞试液,观察溶液颜色 | |
| D. | 加苛性钠溶液,加热,用湿润的红色石蕊试纸在试管口进行检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石蕊试纸和pH试纸使用前都必须用蒸馏水润湿 | |
| B. | 向沸水中滴加饱和氯化铁溶液并不断搅拌,制取氢氧化铁胶体 | |
| C. | 中和滴定实验时,滴定前仰视刻度,滴定后俯视,则对测得浓度无影响 | |
| D. | 滴定管盛装滴定液前需先用蒸馏水洗净,再用滴定液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| B. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12=2Fe3++Br2+4C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和氢气分别在氯气中燃烧,都产生白色烟雾 | |
| B. | 铜丝在氯气中燃烧,生成蓝色的氯化铜 | |
| C. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液呈红色 | |
| D. | 氯水中滴入硝酸银溶液会产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com