
| 6.4g |
| 32g/mol |
| 23×2 |
| 3×8.5 |
| 6.4g |
| 32g/mol |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
 A─E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:
A─E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 该单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
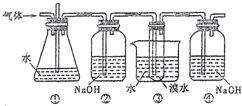 如图是用实验室制得的乙烯(C2H5OH
如图是用实验室制得的乙烯(C2H5OH | 浓硫酸 |
| 170℃ |
| A、装置①和装置③中都盛有水,其作用相同 |
| B、装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C、产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D、制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
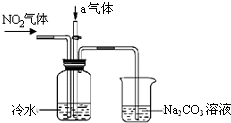 某课外小组模拟工业流程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护).
某课外小组模拟工业流程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护).查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室常用下面装置制备乙稀,请回答下列问题:
实验室常用下面装置制备乙稀,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com