
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;注意该反应前后气体的质量不相等,密度可以作为判断平衡状态的依据.
解答 解:①单位时间内生成2n mol Z,同时消耗2n mol Y,都体现的正反应方向,未体现正与逆的关系,故①错误;
②X的质量不再发生变化,说明正逆反应速率相等,达到了平衡状态,故②正确;
③两边的气体计量数相等,容器中的压强始终不变,则压强的不变不能作为判断平衡状态的依据,故③错误;
④该反应前后气体的质量不相等,而气体的体积不变,所以反应过程中密度会发生变化,当密度不变时,说明正逆反应速率相等,达到了平衡状态,故④正确;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度中等,明确化学平衡状态的特征为解答关键,④为易错点,注意该反应前后气体的质量发生了变化,密度可作为衡量平衡状态的标志.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4N}{V}$ mol-1 | B. | $\frac{VN}{22.4}$mol-1 | C. | $\frac{VN}{11.2}$ mol-1 | D. | $\frac{11.2N}{V}$ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )| A. | 该反应的化学平衡常数表达式为K=c4(H2O)/c4(H2) | |
| B. | 5min时该反应的υ(正)等于9min时的υ(逆) | |
| C. | 0~5min内,υ(H2)=0.10mol/(L•min) | |
| D. | 10min时平衡发生移动可能是投入还原性铁粉引起 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料表 | 精制海盐、碘酸钾[ |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X分子中最多可有9个碳原子共平面 | |
| B. | X可以发生取代、加成、聚合等反应 | |
| C. | 1 mol X与足量NaHCO3溶液反应所得物质的分子式为C9H7O4Na | |
| D. | 苯环上的取代基与X完全相同的X的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
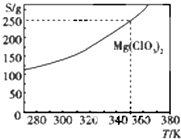 Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ | |
| D. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com