
【题目】一定条件下,向容积为 ![]() 的密闭容器中充入
的密闭容器中充入 ![]() 和
和 ![]() ,发生如下反应:
,发生如下反应:![]() ,
,![]() 后反应达到平衡时
后反应达到平衡时![]() 为
为 ![]() 。
。![]() 的平衡物质的量浓度
的平衡物质的量浓度![]() 与温度关系如图所示。下列说法错误的是
与温度关系如图所示。下列说法错误的是![]()

A.![]() ,
,![]() 的平均反应速率为
的平均反应速率为 ![]()
B.反应![]() 的
的![]()
C.在![]() 时,若反应处于状态D,则一定有
时,若反应处于状态D,则一定有![]()
D.若![]() 、
、![]() 时的平衡常数分别为
时的平衡常数分别为![]() 、
、![]() ,则
,则![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请依据化学知识回答下列问题:
(1)实验测得0.16g CH4完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。则CH4的燃烧热为________kJmol-1。
(2)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)![]() MnO(s)+CO2(g) H1=+a kJmol-1
MnO(s)+CO2(g) H1=+a kJmol-1
ii.2MnO (s)+ O2(g)![]() 2MnO2(s) H2=+b kJmol-1
2MnO2(s) H2=+b kJmol-1
请写出焙烧MnCO3制取MnO2的热化学方程式:______________________________________。
(3)下面是某同学探究可逆反应2NO2(g)![]() N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。
N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。

甲烧杯中NO2球的红棕色变浅。说明平衡2NO2(g)![]() N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
(4)25°C时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请依此判断CH3COOH、H2CO3、HClO的酸性由强到弱的顺序是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,下列判断不正确的是( )
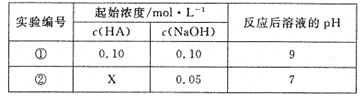
A.X>0.05
B.将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大
C.实验①所得溶液c(A-)+c(HA)=0.10mol·L-1
D.实验②所得溶液: c(Na+)+c(OH-)= c(A-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是
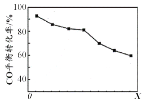
A . 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①②④B.①③④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
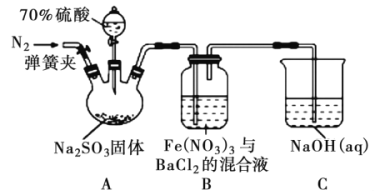
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验及其分析叙述正确的是( )
A.向2.0mL浓度均为0.lmolL-l的KC1、KI混合溶液中滴加1~2滴0.0lmol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2,铜粉仍不溶解
C.向AlC13溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失
D.将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2,也无沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com