
����Ŀ��ijǿ������ҺX�����ܺ���Al3+��Ba2+��NH4+��Fe2+��Na+��CO32����SO42����SiO32����NO3���е�һ�ֻ������ӣ�ȡ����Һ����ʵ�飬������ת������ͼ��ʾ��

��ش��������⣺
(1)�������ʵ����̿��ж���ҺX��һ�������ڵ���������______��
(2)��������A�����ӷ���ʽΪ____________��
(3)��ʵ�������ռ�����A����ѡ����ͼװ���е�______��
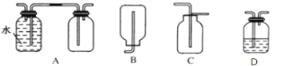
(4)д���ܷ�Ӧ��������ҺH�����ӷ���ʽ____________��
(5)�Բ���ȷ���Ƿ���ڵ����ӣ���������ʵ�鷽��__________��
���𰸡�CO32-��SiO32-��NO3- 3Fe2++4H+ +NO3-=3Fe3++NO��+2H2O A Al3++ 4OH-=AlO2- + 2H2O �ýྻ��˿պȡ�����ڻ��������գ��۲������ɫ����Ϊ��ɫ����˵����Na+������ɫ������Na+��
��������
(1)��ҺX��ǿ���ԣ�����H+��CO32����SiO32���ᷢ����Ӧ�����ܴ������棬���Բ���CO32-��SiO32-����Һ��Ba(NO3)2������ɳ���C����˵����Һ�к�SO42-������Һ�в�����SO42-��Ӧ�γɳ�����Ba2+������C��BaSO4������Ba(NO3)2��Һ��������A��˵�����л�ԭ������Fe2+��������������NO3-����ǿ�����ԣ�������Һ��Fe2+��NO3-���ܹ��棬��Һ�в���NO3-������A��NO��NO��O2��Ӧ����������D��NO2��NO2��O2��ˮ��Ӧ��������ҺE�������ҺB�������NaOH��Һ��������F��F��NH3������Һ�к�NH4+�������백����Ӧ��������泥�����I��NH4NO3��������ҺB�к���Fe2+����������Fe3+�����Բ����ij���G��Fe(OH)3��Fe(OH)3�����ᷴӦ������J��FeCl3����ҺH��ͨ�����������̼���壬��������������Һ�к���Al3+������K��Al(OH)3����ҺL��NaHCO3��
(1)�������ʵ����̿��ж���ҺX��һ�������ڵ���������CO32-��SiO32-��NO3-��
(2)�����������£�Fe2+��NO3-��H+����������ԭ��Ӧ������Fe3+��NO3-����ԭ����NO��ͬʱ��ˮ���ɣ���Ӧ�����ӷ���ʽΪ3Fe2++4H+ +NO3- =3Fe3++NO��+2H2O��
(3)����A��NO������������������е�������Ӧ����NO2�����Բ������ſ��������ռ���ֻ������ˮ�����ռ�������ѡ����A��
(4)����Al3+�����OH-��Ӧ����AlO2-��ˮ�����ӷ���ʽΪ��Al3++ 4OH- =AlO2-+2H2O��
(5)ͨ��ǰ�������֪����ԭ��Һ��һ������Al3+��Fe2+��NH4+��SO42-��һ��������Ba2+��CO32-��SiO32-��NO3-������ȷ����������Na+������Na+���������ʵ�鷽�����ýྻ��˿պȡ�����ڻ��������գ��۲������ɫ����Ϊ��ɫ����˵����Na+������ɫ������Na+��


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�ͬ����ļס��������������������17:14������������H2S���������岻������( )
A.N2B.HClC.C2H4D.CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Fe3O4��һ�ָ��ӵĻ�����仯ѧʽ�ɸ�дΪFeO��Fe2O3������A�����ɵĺ�ɫ���ʣ�������ѧϰС����������ֲ�ͬ�IJ��룬������С��ͬѧ���е�ʵ�������̽�����������С���˼·����ʾ�����ؿհס�
�����룩���飺��ɫ������FeO
���飺��ɫ������Fe3O4
���飺_____________��
��ʵ��̽����
(1)������Ϊһ�ּ��Եķ��������жϼ��������ȡA�����ɵĺ�ɫ�����������ձ�����ϡ����ʹ����ȫ�ܽ⣬�ټ�______��Һ�Լ���Fe3�����۲쵽��Һ������_________�����жϡ�
(2)������Ϊ��ͨ�������ⶨ��ȷ��A�����ɵĺ�ɫ���ʵ���ɣ�����֤���������ȷ��ȡA�����ɵĺ�ɫ����2.32g�ܽ�������ϡ�������������ˮ��������ˮ��Ӧ�����ӷ���ʽΪ��_____________���ټ�������NaOH��Һ����ϴ�Ӻ�����ճ��������Ƶù�������Ϊ________�������ж�����ͬѧ������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦKClO3 + 6HCl= 3Cl2��+KCl + 3H2O�������йص�˵���У���ȷ���ǣ� ��
A. HCl �е�Cl ȫ�������� B. ʧ���ӵ���ԭ���ǵõ��ӵ���ԭ�ӵ�5��
C. ��Ӧ����6mol���ӷ���ת�� D. ��Ӧ��KClO3 ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������Ӧ��û�м����ɵ��� �� ��
A. Na2O2����ˮ B. ���ȵ�����ˮ����
C. ������Ͷ��ˮ�� D. Na2OͶ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����ȡ����غ���ˮ�������й�̽��ʵ�顣
ʵ��һ ��ȡ����غ���ˮ
������ͼ��ʾ��ʵ��װ�ý���ʵ�顣
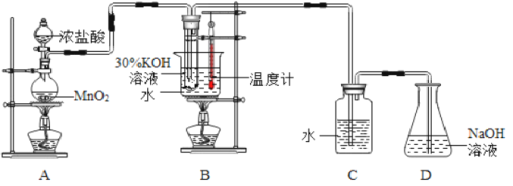
(1)��ȡʵ�������ȡ��B���Թ���ȴ�ᾧ�����ˣ�ϴ�ӡ����˲�����������Ҫ�IJ���������__________��
(2)���Ե�B��Cװ�õ�λ�ã�_____�������������������������B������صIJ��ʡ�Dװ�õ�������___________________��
(3)��ʵ������У���Ҫ����Cװ�õ�ƿ�����Ƿ��ܷ�ã��������ѧ���鷽��_______��
ʵ��� �������⻯�ط�Ӧ���о�
(4)�ڲ�ͬ������KClO3�ɽ�KI����ΪI2��KIO3����С�������ϵ��ʵ���о���Ӧ�����Է�Ӧ�����Ӱ�죬����ϵ��aʵ��ļ�¼���£�ʵ���������½��У���
�Թܱ�� | 1 | 2 | 3 | 4 |
0.2molL��1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3��s��/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL��1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
����ˮ/mL | 9.0 | 6.0 | 3.0 | 0 |
ʵ������ |
��ϵ��aʵ���ʵ��Ŀ����___________________________��
�����1���Թ�ʵ���������__________________________��
����2���Թ�ʵ������Ϊ"��ɫ��Һ",ȡ��������Һ���������Һ����ɫ;������������Ψһ,��ԭ����ΪKCl,��˷�Ӧ�����ӷ���ʽΪ__________________________��
p>ʵ���� �ⶨ������ˮ����Ԫ�ص�����(5)�����������ϣ�Ϊ��С�����һ�����е�ʵ�鷽�������������������̵�ϸ�ڣ���____��
���ϣ�i����������ƻ����ָʾ����
ii��������������ɱ�SO2��H2O2��FeCl2�����ʻ�ԭ��Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-283.0kJ��mol-1��-726.5kJ��mol-1����ô��̫���ֽܷ�10molˮ���ĵ�������____________kJ��
��2���ɺϳ��������ΪH2��CO��������CO2��ֱ���Ʊ������ѣ����е���Ҫ���̰��������ĸ���Ӧ��
�״��ϳɷ�Ӧ��
��i��CO(g) + 2H2(g) = CH3OH(g) ��H1 = -90.1kJmol-1
��ii��CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ��H2 = -49.0kJmol-1
ˮú���任��Ӧ��
��iii��CO(g) + H2O(g) = CO2(g) + H2 (g) ��H3 = -41.1kJmol-1
�����Ѻϳɷ�Ӧ��
��iV��2 CH3OH(g) = CH3OCH3(g) + H2O(g) ��H4 = -24.5kJmol-1
����H2��COֱ���Ʊ������ѣ���һ����Ϊˮ���������Ȼ�ѧ����ʽΪ____________��
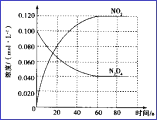
��3�����ݻ�Ϊ1.00L�������У�ͨ��һ����N2O4������N2O4(g) ![]() 2NO2(g), 100��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60sʱ�Σ�v(N2O4)=_______________________��
2NO2(g), 100��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60sʱ�Σ�v(N2O4)=_______________________��
��4����֪��Ӧ2HI��g��=H2(g) + I2(g)�Ħ�H= +11kJ��mol-1��1molH2��g����1mol I2��g�������л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1molHI��g�������л�ѧ������ʱ�����յ�����Ϊ___________kJ����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±�
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
������Ӧ�У�����Ӧ����Ϊv��= k����x2(HI)���淴Ӧ����Ϊv��=k����x(H2)��x(I2)������k����k��Ϊ���ʳ����� ��k�� = 0.0027min-1����t=40minʱ��v��=_______min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ��������·�Ӧ��ȡ����������NaNO2+NH4Cl![]() NaCl+N2��+2H2O�����ڸ÷�Ӧ������˵������ȷ����( )
NaCl+N2��+2H2O�����ڸ÷�Ӧ������˵������ȷ����( )
A. Na2NO2����������NH4Cl��ԭ��
B. N2��������������ǻ�ԭ����
C. NH4Cl�е�Ԫ�ر���ԭ
D. ÿ����1molN2ת�Ƶ��ӵ����ʵ���Ϊ3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¹��������о�����2010��2��19���������ɸ������˹��ϳɵĵ�ll2�Ż�ѧԪ�شӼ��������ʽ������Copemicium������Ӧ��Ԫ�ط���Ϊ��Cn������Ԫ�ص�������Ϊ�˼�����������ѧ�Ҹ������������������˹��ϳ�Cn�Ĺ��̿ɱ�ʾΪ��7030Zn+20882Pb��277112Cn+10n��������������ȷ���� �� ��
A. �����ϳɹ������ڻ�ѧ�仯
B. CnԪ��λ��Ԫ�����ڱ��ĵ������ڣ��Ǹ���Ԫ��
C. CnԪ�ص����ԭ������Ϊ277
D. 277112Cn��ԭ�Ӻ�������������������53
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com