
| A.AgCl>AgI> Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
科目:高中化学 来源:不详 题型:单选题
| A.AgCl>AgI> Ag2CrO4 | B.Ag2CrO4>AgCl>AgI |
| C.AgCl> Ag2CrO4>AgI | D.Ag2CrO4>AgI>AgCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有难溶电解质才存在沉淀溶解平衡过程 |
| B.沉淀溶解平衡过程是可逆的 |
C.在平衡状态时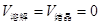 |
| D.达到沉淀溶解平衡的溶液不一定是饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
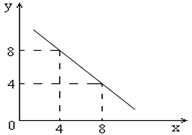
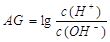 。则该温度下,0.01mol/L盐酸的酸度AG= 。
。则该温度下,0.01mol/L盐酸的酸度AG= 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25°C时Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小 |
| D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| D.该过程破坏了ZnS的溶解平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com