
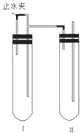
 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.分析 (1)根据FeSO4易被空气中的氧气氧化和易水解的特点分析;
(2)根据气体的溶解度随温度的升高而减小分析;
(3)根据氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁分析;
(4)试管Ⅰ里加入的试剂是铁与稀硫酸反应生成硫酸亚铁与氢气;
(5)用氢气作保护气的方法来保证新制的氢氧化亚铁不被氧化,先打开止水夹,反应一段时间后检验A口排出气体的纯度,氢气纯时,说明空气排尽,关闭止水夹,据此分析解答;
解答 解:(1)根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4防止 发生水解反应,同时加入铁屑防止硫酸亚铁被氧化.
故答案为:铁屑;
(2)蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,由于氧气的溶解度随温度的升高而减小,因此可采用加热煮沸的方法除去.
故答案为:加热煮沸;
(3)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的.
故答案为:用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液;
(4)试管Ⅰ里加入的试剂是铁与稀硫酸反应生成硫酸亚铁与氢气,所以试管Ⅰ的试剂为:铁与稀硫酸,故答案为:铁与稀硫酸;
(5)打开止水夹,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后关闭止水夹,左侧试管内气压升高,反应生成的Fe2+沿导管进入右侧试管与NaOH反应生成白色沉淀Fe(OH)2.若过早关闭止水夹,使左侧试管中的硫酸压入右侧试管中,将NaOH中和,则得不到Fe(OH)2溶液.故答案为:检验试管Ⅱ出口处排出的氢气的纯度.当排出的H2纯净时,再夹紧止水夹.
点评 Fe(OH)2很容易被空气中的氧气氧化,这是Fe(OH)2的重要性质,本题是在原有性质基础上进行了改编,设计成了探究型实验题,此题考查的内容比较多,既有水解方面的问题,又有氧化还原方面的问题,还有实验中的实际问题,同时还考查了实验的设计,可以说是一道不可多得的好题.


科目:高中化学 来源: 题型:选择题
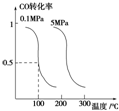
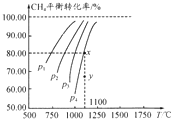 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | 压强P1>P2>P3>P4 | |
| C. | 1100℃时该反应的平衡常数约为1.64 | |
| D. | 压强为P4时,y点的v正<v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
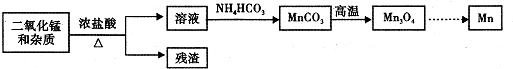
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Ba(N03)2溶液鉴别CaCl2溶液和(NH4)2SO4溶液 | |
| B. | 用稀硫酸鉴别碳酸钠固体和碳酸钾固体 | |
| C. | 用湿润的蓝色石蕊试纸鉴别氨气和氢气 | |
| D. | 用淀汾溶液鉴别加碘盐(含KI03)和未加碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
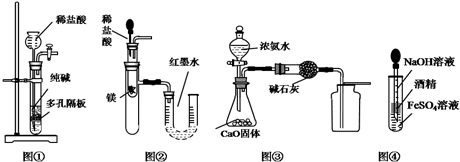
| A. | 用图①所示装置制取少量纯净的CO2气体 | |
| B. | 用图②所示装置验证镁和盐酸反应的热效应 | |
| C. | 用图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 用图④装置制备Fe(OH)2并能保证较长时间观察到白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时负极附近溶液的酸性增强 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
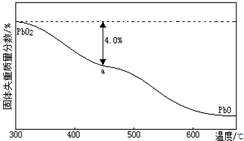 (1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O.PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为PbO+ClO-=PbO2+Cl-.
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O.PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为PbO+ClO-=PbO2+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| C. | 得到2.54 g沉淀时,加入NaOH溶液的体积是60 mL | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com