
分析 4.66g沉淀是硫酸钡的质量,根据n=$\frac{m}{M}$计算硫酸钡的物质的量,根据方程式计算10mL混合酸液中n(H2SO4),再根据c=$\frac{n}{V}$计算硫酸的物质的量浓度;
滤液中氢离子的物质的量等于硫酸和硝酸电离产生的氢离子,加入NaOH溶液,发生反应H++OH-=H2O,根据n=cV计算消耗的氢氧化钠的物质的量,进而计算10mL原混合酸液中n(H+),原10mL混合酸液中n(H+)=n(HNO3)+2n(H2SO4),据此计算原10mL溶液中n(HNO3),再根据c=$\frac{n}{V}$计算硝酸的物质的量浓度.
解答 解:由H2SO4+BaCl2=BaSO4?+2HCl,可知n(H2SO4)=n(BaSO4)=$\frac{4.66g}{233g•mo{l}^{-1}}$=0.0200 mol,所以c(H2SO4)=$\frac{0.0200mol}{0.01000L}$=2.00mol•L-1;
滤液中氢离子的物质的量等于硫酸和硝酸电离产生的氢离子,加入NaOH溶液,发生反应H++OH-=H2O,消耗的氢氧化钠的物质的量为0.035L×2mol/L=0.07mol,故10mL原混合酸液中n(H+)=n(NaOH)=0.07mol,原10mL混合酸液中n(H+)=n(HNO3)+2n(H2SO4),故n(HNO3)=0.07mol-2×0.02mol=0.03mol,故原混合酸液中硝酸的物质的量浓度为$\frac{0.03mol}{0.01L}$=3mol/L;
答:原混合酸液中H2SO4的物质的量浓度为2mol/L,HNO3的物质的量浓度为3mol/L
点评 本题考查混合物的有关计算,难度中等,清楚发生的反应是关键,注意守恒法运用.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 阴极 | B. | 阳极 | C. | 正极 | D. | 负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缺维生素A易患夜盲症 | B. | 缺铁易患白血病 | ||
| C. | 缺维生素C易患坏血病 | D. | 缺维生素D易患佝偻病 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 | |
| B. | 用10mL量筒量取8.58mL蒸馏水 | |
| C. | 容量瓶定容时观察液面时俯视,会使配得的溶液浓度偏大 | |
| D. | 用酒精萃取碘水中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
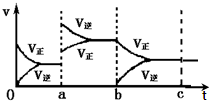 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4Vρ}$×100%mol/L | |
| C. | 上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 上述氨水中再加入V mL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| O=O(g) | H-H(g) | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | X | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com