
| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA |
分析 A.质量换算物质的量结合化学式计算;
B.每个碳原子有4个价键,对于烃CxHy分子,除了氢原子之外就是碳与碳之间的共用电子对,由于每两个碳共用这些电子对,因此碳与碳之间的共用电子对数为:$\frac{4x-y}{2}$,利用此公式代入即可求解即可.
C.乙酸、葡萄糖的最简式都是CH2O,60g混合物中含有2mol最简式CH2O,完全燃烧消耗2mol氧气;
D.该反应中Cl元素化合价由+5价、-1价变为0价,有$\frac{1}{6}$的HCl不作还原剂,起酸的作用,氧化剂是K37ClO3、还原剂 H35Cl,该反应转移的电子数为5e-.
解答 解:A.5.8g 2CaSO4•H2O物质的量=$\frac{5.8g}{290g/mol}$=0.02mol,含有的结晶水分子数为0.02NA,故A正确;
B.分子式为CnH2n-2的烃分子中碳碳间共用电子对数为:$\frac{4n-(2n-2)}{2}$=n+1,所含的共用电子对数为(n+1)NA,故B错误;
C.60g乙酸、葡萄糖的混合物中含有2mol最简式CH2O,完全燃烧时消耗2mol氧气,消耗氧气分子数为2NA,故C正确;
D.生成的3mol氯气中含6molCl,其中1mol为 37Cl,5mol为35Cl,生成氯气摩尔质量=$\frac{1×37+5×35}{3}$=70.7g/mol,若有212克氯气生成物质的量=$\frac{212g}{70.7g/mol}$=3mol,生成3mol氯气电子转移5mol,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意明确氧化还原反应关系,计算生成氯气的物质的量是解题关键.


科目:高中化学 来源: 题型:多选题
| A. | 1:1 | B. | 4:3 | C. | 3:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
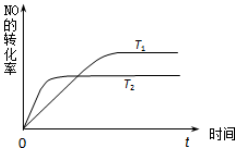 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  蒸干CuCl2饱和溶液制备无水CuCl2 | |
| B. | 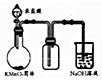 实验室制取并收集少量纯净氯气 | |
| C. | 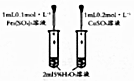 研究催化剂对H2O2分解速率的影响 | |
| D. | 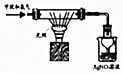 验证甲烷和氧气光照条件下发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W一定是氢元素 | |
| B. | 简单离子半径rz>rx>ry | |
| C. | 标准状况下,1mol Z的最高价氧化物的体积约为22.4L | |
| D. | 工业上常用电解熔融Y的氯化物的方法制备Y单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
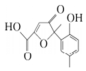
| A. | 该化合物分子中不含手性碳原子 | |
| B. | 该化合物与NaHCO3溶液作用有CO2气体放出 | |
| C. | 1 mol该化合物与足量溴水反应,消耗2 mol Br2 | |
| D. | 在一定条件下,该化合物与HCHO能发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | MgO、Al2O3的熔点都很高,都可用作耐火材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com