

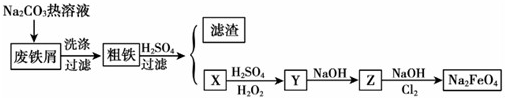
分析 (1)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(2)根据生产工艺流程图,反应①中氯气过量,在温度较高时KOH 与Cl2 反应生成的是KClO3需要碱性条件,氧化还原反应中化合价有升有降;
(3)根据生产工艺流程图,利用元素守恒可知,硝酸铁与次氯酸钾在碱性条件下反应得溶液II中含有高铁酸钾、硝酸钾和氯化钾,检验最后一次的洗涤中无Cl-即可;
(4)根据题目信息、氧化还原反应中化合价发生变化可知,高铁酸钾与水反应生成氢氧化铁胶体,利用元素守恒和电子得失守恒确定产物并书写离子方程式;
(5)根据铁元素守恒可计算制得K2FeO4晶体的质量.
解答 解:(1)据题目信息、氧化还原反应中化合价发生变化确定产物有:KClO3、KCl、H2O,根据电子得失守恒和质量守恒来配平,可得6KOH+3Cl2$\frac{\underline{\;加热\;}}{\;}$KClO3+5KCl+3H2O,
故答案为:6KOH+3Cl2$\frac{\underline{\;加热\;}}{\;}$KClO3+5KCl+3H2O;
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为 KClO,化合价只降不升,故D错误;
故选:A、C;
(3)根据生产工艺流程图,利用元素守恒可知,硝酸铁与次氯酸钾在碱性条件下反应得溶液II中含有高铁酸钾、硝酸钾和氯化钾,所以从溶液II中分离出K2FeO4后,同时得到副产品有KCl、KNO3,因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净,所以操作为用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净,
故答案为:KCl、KNO3;用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净;
(4)根据题目信息、氧化还原反应中化合价发生变化可知,高铁酸钾与水反应生成氢氧化铁胶体,利用元素守恒和电子得失守恒可写出离子方程式为4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,
故答案为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-;
(5)90%的硝酸铁溶液268.9g中,n(Fe)=$\frac{268.9×90%}{56+3×62}$mol=1.0mol,根据铁元素守恒,n(K2FeO4)=1.0mol,则K2FeO4晶体的质量为1.0×(39×2+56+16×4)g=198.0g,
故答案为:198.0g.
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,培养了学生运用知识的能力,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 氯化铁溶液腐蚀铜线路板Cu+Fe3+=Cu2++Fe2+ | |
| C. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 氯气溶于水:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | NH4HCO3溶液中加入过量的NaOH溶液并加热:HCO3-+OH+$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+H2O | |
| C. | 稀硝酸除银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2═2Fe3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
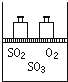 如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:
如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中所有的反应均为氧化还原反应 | |
| B. | 反应①②均为离子反应 | |
| C. | 反应②③都能产生氢气,且产生等量氢气消耗Al的质量和转移电子数分别相等 | |
| D. | 反应①②⑦中铝均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性按X、Y、Z的顺序减弱 | |
| B. | 单质的氧化性按X、Y、Z的顺序增强 | |
| C. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com