
| A、AgCl沉淀在氨水中溶解:AgCl+2NH3?H2O═Ag(NH3)2++Cl-+2H2O |
| B、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-+OH-=BaCO3↓+H2O |
| C、氨气通入醋酸溶液中:NH3+H+=NH4+ |
| D、向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |


科目:高中化学 来源: 题型:
 ,(注:R,R′为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
,(注:R,R′为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,某容积恒定的密闭容器中发生如下可逆反应:
一定温度下,某容积恒定的密闭容器中发生如下可逆反应:| A、起始时刻和t1达到平衡后气体的物质的量之比为5:4 |
| B、平衡后若加入少量碳,平衡向逆反应方向移动 |
| C、平衡后若加入氢气,上述反应的△H会增大 |
| D、t2时改变的条件可能是升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COO-、I-、SO32- |
| B、I-、NH4+、HCO3- |
| C、CH3COO-、I- |
| D、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
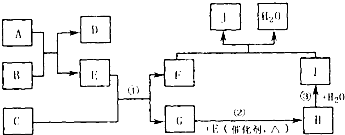
查看答案和解析>>
科目:高中化学 来源: 题型:
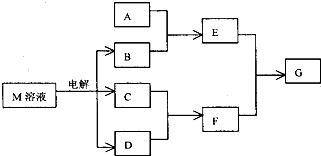 已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):
已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L的某碱液其pH小于13而大于7,此碱为弱碱 |
| B、pH=1的某酸稀释10倍后,1<pH<2,此酸为弱酸 |
| C、pH=13的某碱稀释10倍后,12<pH<13,此碱为弱碱 |
| D、0.1 mol/L的某酸,被NaOH中和至pH=7时,所反应的NaOH物质的量大于该酸物质的量,则此酸为弱酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com