
[��ѧ---���ʽṹ������]
������Ȼ���г���CaF2����ʽ���ڡ�
��1�����й���CaF2�ı�����ȷ����_______��
a��Ca2����F��������ھ�����������
b��F�������Ӱ뾶С��Cl������CaF2���۵����CaCl2
c���������ӱ�Ϊ2��1�����ʣ�����CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��2��CaF2������ˮ���������ں�Al3������Һ�У�ԭ����________(�����ӷ���ʽ��ʾ)��
��֪AlF63-����Һ�п��ȶ����ڡ�
��3��F2ͨ��ϡNaOH��Һ�п�����OF2��OF2���ӹ���Ϊ______________��������ԭ�ӵ��ӻ���ʽΪ_________��
��4��F2������±�ص��ʷ�Ӧ�����γ�±�ػ��������ClF3��BrF3�ȡ���֪��ӦCl2(g)��3F2(g)=2ClF3(g) ��H=��313kJ·mol��1��F��F���ļ���Ϊ159kJ·mol��1��Cl��Cl���ļ���Ϊ242kJ·mol��1����ClF3��Cl��F����ƽ������Ϊ______kJ·mol��1��ClF3���ۡ��е��BrF3��________(��ߡ��͡�)��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������л���ķ���ʽ��ΪC4H10O��

(1)�ܱ������ɺ���̼ͬԭ������ȩ����__________��
(2)�ܱ�������ͪ����__________��
(3)�ܷ�����ȥ��Ӧ���������ֲ������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������£���E(g)��F(g)������������2 L�ܱ������У�����������Ӧ������5 minĩ�ﵽƽ�⣺2E(g)��F(g)2G(g)���й��������£�
| E(g) | F(g) | G(g) | |
| ��ʼŨ��/mol��L��1 | 2.0 | 1.0 | 0 |
| ƽ��Ũ��/mol��L��1 | c1 | c2 | 0.4 |
�����ж���ȷ����(����)
A����Ӧ��ǰ5 min�ڣ�v(E)��0.04 mol��L��1��min��1
B�������������䣬������E��Ũ�ȣ����ƽ��ʱE��ת���ʻ�����
C�������������䣬�����¶ȣ�ƽ��ʱn(E)��3.0 mol����Ӧ�Ħ�H��0
D��ƽ�������2.0 mol E��1.0 mol F������ͬ�������ٴ�ƽ��ʱ��c(G)��0.2 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������£�����H2SO4��CuSO4��Һ����μ��뺬a mol���ʵ�NaOH��Һ��ǡ��ʹ��Һ��pH��7������������ȷ����(����)
A����Һ��c(Na��)��2c(SO )
)
B��0<���������ʵ���<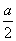 mol
mol
C�����������ʵ���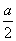 mol
mol
D��ԭ��Һ��c(H2SO4)��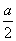 mol��L��1
mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������10mL0.1 mol·L��1NaOH��Һ�м���0.1 mol·L��1��һԪ��HA��ҺpH�ı仯������ͼ��ʾ������˵����ȷ����
A��a����ʾ��Һ��c(Na+)>c(A—)>c(H+)>c(HA)
B��a��b������ʾ��Һ��ˮ�ĵ���̶���ͬ
C��pH=7ʱ��c(Na+)= c(A—)+ c(HA)
D��b����ʾ��Һ��c(A—)> c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�йء���ʪ�������ӵĸ���ˮ����֬������˵���в���ȷ����
����������
A���õ��ۡ���ά�ص���Ȼ�߷��ӻ��������ϩ�ᡢ����ϩ���ᷢ���ۺϷ�Ӧ�Ƶ�
B���þ���ϩ�����ϩ�ᷴӦ�Ƶ�
C�����Ҷ������Ҷ��ᷢ�����۷�Ӧ�Ƶ�
D������ˮ����֬�Ǻ����Ȼ����ǻ���ǿ��ˮ���Ų�����һ����������״�߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij���Ͻ�Ӳ�����к���þ��ͭ���裬Ϊ�˲ⶨ�úϽ������ĺ����������������ʵ�飺
��1��ȡ��Ʒa g������ʱʹ�õ���������Ϊ________________________________________________________________________��
��2������Ʒ����������ϡ�����У����ˣ���Һ����Ҫ���С����������� �������к��С������������ܽ⡢����ʱʹ�õ�����Ϊ________________________________________________________________________��
��3������Һ�м������������������Һ�����ˣ�д���ò�������з�Ӧ�Ļ�ѧ����ʽ______________________________________________��
��4���ڵڣ�3��������Һ��ͨ������CO2�����ˣ�������������ˮϴ�����κ�ɲ��������������ټ���Ϊֹ����ȴ�����������Ϊb g��
��5���Ͻ���������������Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ж�������ȷ�Ļ����̡�������Ļ�������
(1)Ca(OH)2���Ƴɳ���ʯ��ˮ�����Կ�����2.0 mol·L��1��Ca(OH)2��Һ(����)
(2014·�㶫���ۣ�9D)
(2)�ܽ��С�ij��������ܽ�ȸ�С�ij���ת��������ZnS�����еμ�CuSO4��Һ���Եõ�CuS����(����)
(2014·�������ۣ�12D)
(3)��֤Fe(OH)3���ܽ��С��Mg(OH)2���ɽ�FeCl3��Һ����Mg(OH)2����Һ�У����ɹ۲쵽�����ɰ�ɫ��Ϊ���ɫ(����)
(2014·�Ĵ����ۣ�4D)
(4)25 ��ʱCu(OH)2��ˮ�е��ܽ�ȴ�������Cu(NO3)2��Һ�е��ܽ��(����)
(2014·�������ۣ�3D)
(5)AgCl������ת��ΪAgI������K(AgX)��c(Ag��)·c(X��)����K(AgI)��K(AgCl)(����)
(2013·�������ۣ�2D)
(6)CaCO3������ϡ���ᣬҲ�����ڴ���(����)
(2013·������ۣ�5B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(һ)ʵ�鷽���ⶨ��Ӧ��---------�к��Ȳⶨ
��1��ʵ�����ϱ����ձ�����С�����ձ�������ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β�������0.5mol�� L-1 ���ᡢ0.55mol�� L-1NaOH��Һ����ȱ�ٵ�ʵ�鲣����Ʒ�� �� ��
| ʵ �� �� Ʒ | �� Һ �� �� | �к��ȡ�H | |||
| t1 | t2 | ||||
| �� | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20�� | 23.3�� | |
| �� | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20�� | 23.5�� |
��2�����Ǽ�¼��ʵ���������£�
��֪��Q=Cm(t2 -t1)����Ӧ����Һ�ı�����CΪ4.18KJ����-1�� Kg-1�������ʵ��ܶȾ�Ϊ1g��cm-3��
��������ϱ�����H=
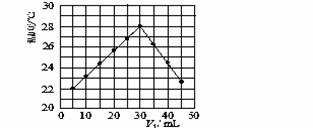
��3��ij�о�С�齫V1 mL 1.0 mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ(ʵ����ʼ�ձ���V1��V2��50 mL)���ش��������⣺
�о�С������ʵ��ʱ�����¶� (����ڡ��������ڡ����ڡ�)22 �棬�˷�Ӧ����NaOH��Һ��Ũ��ӦΪ mol/L��
������ͨ����ѧ�����ӻ��
��1����֪��1mol��H��H����I��I��H��I���ֱ���Ҫ���յ�����Ϊ436kJ��153kJ��299kJ��
��ӦH2(g)��I2(g)��2HI(g)�ķ�Ӧ�ȡ�H�� kJ��mol��1
��2����֪��2H2(g)+ O2(g) �� 2H2O (l) ��H����571.6 kJ��mol��1
H2(g)+1/2O2(g) �� H2O(g) ��H����241.8 kJ��mol��1
����������Ӧȷ����H2ȼ����Ϊ kJ��mol��1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com