
| A. | CH2═CH2与CH3CH2OH均可以使KMnO4(H+)褪色,且褪色原理相同 | |
| B. | 乙酸乙酯的制取中,水浴加热的目的有:加快化学反应速率,同时使产物分离,平衡正向移动 | |
| C. | 等质量的CH3CH2OH与CH3COOH,均能与足量的金属钠发生取代反应,前者反应速率较后者慢,且生成等物质量的H2 | |
| D. | 在一溴乙烷中加入NaOH和CH3CH2OH,加热,加入HNO3酸化的AgNO3,出现淡黄色沉淀,说明溴乙烷发生了水解反应 |
分析 A.碳碳双键和乙醇都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
B.反应加热 提高反应速率,乙酸乙酯沸点低,加热蒸出乙酸乙酯;
C.氢离子浓度越大,反应速率越快,乙醇和乙酸分别与钠反应生成的氢气与其物质的量成正比;
D.溴乙烷和NaOH的醇溶液加热发生消去反应.
解答 解:A.碳碳双键和乙醇都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,二者都发生氧化反应,所以反应原理相同,故A正确;
B.实验中加热小试管的,可以提高反应速率,乙酸乙酯沸点低,加热利于蒸出乙酸乙酯,故B错误;
C.氢离子浓度越大,反应速率越快,乙醇是非电解质、乙酸是电解质,所以后者氢离子浓度大于前者,则反应速率后者大于前者,等质量的乙醇和乙酸,乙醇的物质的量大于乙酸,等质量的乙醇和乙酸,分别与足量Na反应生成氢气与醇或酸的物质的量成正比,所以乙醇生成的氢气多,故C错误;
D.溴乙烷和NaOH的醇溶液发生消去反应,和氢氧化钠的水溶液加热发生水解反应,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意溴乙烷发生水解反应和消去反应条件的差异,易错选项是A.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 该物质的分子式为C3H8O | |
| B. | 分子中共有6种化学环境不同的氢原子 | |
| C. | 该有机物的结构简式为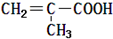 | |
| D. | 该有机物可能与新制的氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+4H++2MnO4-═5SO42-+2Mn2++2H2O | |
| D. | 向AlCl3溶液滴入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置除去乙酸乙酯中混有的少量乙酸 | |
| B. |  用装置除去氯气中的少量氯化氢 | |
| C. | 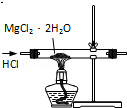 用装置制取无水MgCl2 | |
| D. |  用装置制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
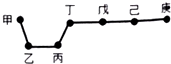
| A. | 单质甲与单质乙充分反应一定都可以生成多种化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊>丁 | |
| C. | 可以通过分别电解熔融的金属氯化物的方法冶炼乙和丙的单质 | |
| D. | 因为庚元素的非金属性最强,所以庚的最高价氧化物对应水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

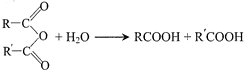
 ,G
,G

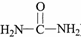 )氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式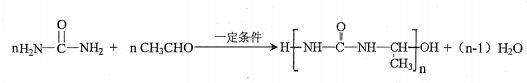
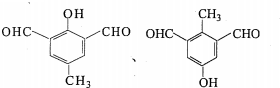 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
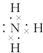 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com