


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
(5分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是_________________。(用序号填一种合理组合)。
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
由无水MgCl2制取Mg的化学方程式为_____________________________________。海
水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012届黑龙江大庆市三十二中高三毕业班联考化学试卷 题型:填空题
(5分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是_________________。(用序号填一种合理组合)。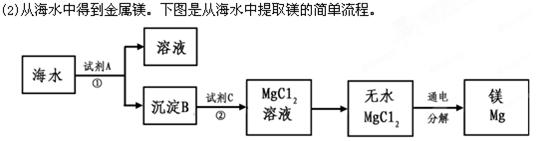 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
由无水MgCl2制取Mg的化学方程式为_____________________________________。海
水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江大庆市高三毕业班联考化学试卷 题型:填空题
(5分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是_________________。(用序号填一种合理组合)。
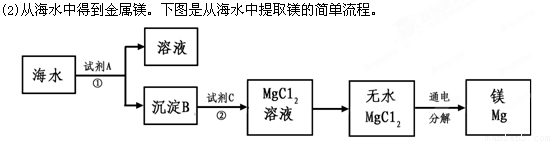 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
由无水MgCl2制取Mg的化学方程式为_____________________________________。海
水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:填空题
 等离子。
等离子。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com