
| A. | 开始析出晶体后用玻璃棒搅拌 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 | |
| D. | 将制得晶体转移到新制过滤器中用大量水进行洗涤 |
分析 A.实验开始就需要用玻璃杯搅拌;
B.加热蒸发氯化钠溶液得到氯化钠晶体时应在蒸发皿中进行;
C.蒸发时,蒸发皿中出现大量固体时,停止加热;
D.用少量水洗涤制得的晶体.
解答 解:A.用酒精灯加热的同时用玻璃棒不断搅拌滤液,使液体均匀受热,防止局部过热,造成液滴飞溅,而不是等到出现固体时再用玻璃棒搅拌,故A错误;
B.滤液应该移至蒸发皿中加热,不能使用坩埚,故B错误;
C.蒸发时,当有大量晶体析出时应停止加热,用余热蒸干滤液,以免晶体受热后飞溅出来,不仅造成损失,还可能因此发生意外事故,故C正确;
D.晶体应该用少量水洗涤,否则导致制得的晶体会溶于水,造成损失,故D错误;
故选C
点评 本题考查了粗盐的提纯方法,题目难度不大,明确粗盐的提纯步骤、操作方法为解答关键,B为易错点,注意蒸发溶液需要在蒸发皿中进行,试题培养了学生的化学实验能力.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:实验题
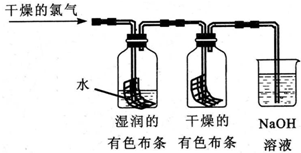
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是否是大量分子或离子的集合体 | B. | 分散质粒子的大小 | ||
| C. | 是否能通过滤纸 | D. | 是否有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
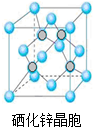 【化学-选修3物质结构与性质】
【化学-选修3物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一能层的px、py、pz轨道电子能量相同 | |
| B. | 3d3表示3d能级有3个轨道 | |
| C. | p轨道电子能量不一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应物 | 生成物 | 反应物 | 生成物 |
| 镁和氧气 | 氧化镁 | 镁和水 | 氧化镁和氢气 |
| 镁和氮气 | 氮化镁 | 氮化镁和水 | 氢氧化镁和氨气 |
| 镁和二氧化碳 | 氧化镁和碳 |
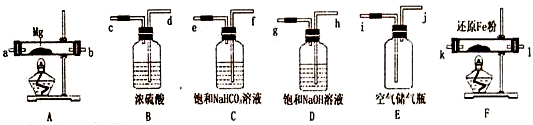
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,立即用水灭火 | |
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 | |
| C. | 酒精灯不慎着火,应立即吹熄 | |
| D. | 眼睛里溅进盐酸,立即用 NaOH 溶液洗涤眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
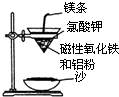 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com