
 如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )
如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )| A. | X和Z氢化物的热稳定性和还原性均依次减弱 | |
| B. | R、W和氢三种元素形成的阴离子有2种以上 | |
| C. | RY2分子中每个原子的最外层均为8电子结构 | |
| D. | R、Y、Z的最高价氧化物对应的水化物的酸性依次增强 |
分析 由元素在周期表中的位置可知,R、W、X位于第二周期,Y、Z位于第三周期,Z原子的电子层数为n,则n=3,其最外层电子数为2n+1,故Z原子最外层电子数为7,则Z为Cl;可推知R为碳元素、W为O、X为F、Y为S,以此解答该题.
解答 解:R为碳元素、W为O、X为F、Y为S,Z为Cl,
A.元素的非金属性越强,对应的氢化物越稳定,但还原性越弱,HCl的还原性比HF强,故A错误;
B.C、O和氢三种元素形成的阴离子有HCO3-、CO32-、HCOO-等,故B正确;
C.CO2分子中C的最外层电子数为4+4、O的电子数为6+2=8,则每个原子的最外层均为8电子结构,故C正确;
D.非金属性Cl>S>C,元素的非金属性越强,对应的最高价氧化物对应的水化物的酸性越强,故D正确.
故选A.
点评 本题考查结构位置性质关系、元素周期表与元素周期律等,为高频考点,侧重考查学生的分析能力,比较基础,注意整体把握元素周期表的结构与元素周期律.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:推断题
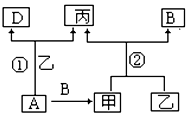 已知A、B、D为单质,其中B、D在常温常压下为气体.甲、乙、丙为常见化合物,甲、丙的焰色反应均为黄色,乙常温下为液体,有关转化关系如图所示:
已知A、B、D为单质,其中B、D在常温常压下为气体.甲、乙、丙为常见化合物,甲、丙的焰色反应均为黄色,乙常温下为液体,有关转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止食品的氧化变质,常在食品包装袋中放入生石灰 | |
| B. | 节日里绚丽的烟花,是通过某些金属元素的化学变化实现的 | |
| C. | SO2具有漂白性,通常用于银耳等食品的漂白 | |
| D. | 干冰或碘化银可用于进行人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验过程中要用到氧化剂 | |
| B. | 检验碘单质是否存在,可用碘化钾溶液 | |
| C. | 要萃取碘水中的碘,可以用汽油或酒精 | |
| D. | 利用如图所示装置不能分离食盐和晶体碘的混和物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向含有氯化铁杂质的氯化铜溶液中加入铜 | 除去氯化铁杂质 |
| B | 向某溶液中加入盐酸话的氯化钡溶液 | 效验SO${\;}_{4}^{2-}$的存在 |
| C | 常温下,用pH计测定NaHCO3溶液的pH | 比较HCO${\;}_{3}^{-}$水解、电离程度的相对大小 |
| D | 将SO2通入Ba(NO3)2溶液中 | 证明BaSO3不溶于水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2NH中N的化合价是-1 | B. | 此法储氢和钢瓶储氢的原理相同 | ||
| C. | H+与H -的离子半径均比Li+大 | D. | 该反应中H2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验→分类(预测Br2的化学性质)→观察(得出Br2的物理性质)→比较并得出结论 | |
| B. | 分类(预测Br2的化学性质)→观察(得出Br2的物理性质)→实验→比较并得出结论 | |
| C. | 观察(得出Br2的物理性质)→实验→分类(预测Br2的化学性质)→比较并得出结论 | |
| D. | 观察(得出Br2的物理性质)→分类(预测Br2的化学性质)→实验→比较并得出结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
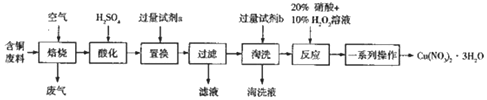
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com