
| A. | 反应物总能量低于生成物总能量时,该反应一定不能发生 | |
| B. | 化学键的键能越大,物质的能量越高 | |
| C. | 一个反应的焓变因反应物的用量和反应条件的改变而发生改变 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
分析 A.反应物总能量低于生成物总能量,则吸热反应,一定条件下能发生;
B.物质的键能越大,说明物质内的微粒结合更加牢固,不容易被拆开,要拆开需要更多的能量;
C.焓变与反应条件无关;
D.CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变;
解答 解:A.反应物总能量低于生成物总能量,则吸热反应,一定条件下能发生,所以反应物总能量低于生成物总能量时,该反应也能能发生,碳酸钙在高温条件下能发生分解反应,故A错误;
B.物质的键能越大,说明物质内的微粒结合更加牢固,不容易被拆开,要拆开需要更多的能量,于是该物质就难于发生化学反应,比较稳定,能量越低的物质越稳定,所以,键能越大的物质能量越低,故B错误;
C.焓变与反应条件无关,所以一个反应的焓变不随反应物的用量和反应条件的改变而发生改变,故C错误;
D.CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变,故D正确;
故选D.
点评 本题考查了化学反应能量变化,主要是盖斯定律应用、化学键键能和反应焓变的计算等知识,掌握基础是解题关键,题目较简单.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
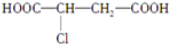 $→_{△}^{NaOH_{2}醇}$D$\stackrel{H+}{→}$E$→_{浓H_{2}SO_{4}}^{CH_{3}OH}$CH3OOC-CH=CH-COOCH3,则B物质应为下列哪种物质( )
$→_{△}^{NaOH_{2}醇}$D$\stackrel{H+}{→}$E$→_{浓H_{2}SO_{4}}^{CH_{3}OH}$CH3OOC-CH=CH-COOCH3,则B物质应为下列哪种物质( )| A. | 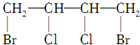 | B. | 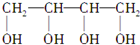 | C. | 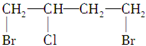 | D. | 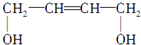 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能 (kJ/mol) | 414 | 615 | 347 | 435 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
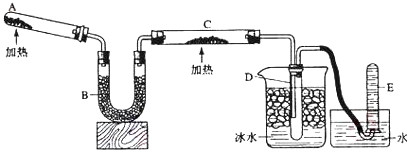
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
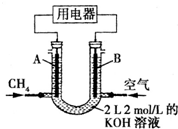 将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com