
����Ŀ��ʵ������50mL 0.50mol/L���ᡢ50mL0.55mol/L NaOH��Һ����ͼ��ʾװ�ã����вⶨ�к��ȵ�ʵ�飬�õ����е�������
ʵ����� | ��ʼ�¶�/�� | ��ֹ�¶�/�� | |
���� | NaOH��Һ | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
�������������
(1)ʵ��ʱ������ͭ˿��������滷�β����������������___��ʵ����ʹ�û��β���������IJ���������____��
(2)�ڲ�����ȷ��ǰ���£�����к��Ȳⶨȷ�ԵĹؼ���_____��
(3)���ݱ����������ݽ��м��㣬���ʵ���õ��к���![]() =_____ [�����NaOH��Һ���ܶȰ�1
=_____ [�����NaOH��Һ���ܶȰ�1![]() ���㣬��Ӧ������Һ�ı�����(c)��4.18
���㣬��Ӧ������Һ�ı�����(c)��4.18![]() ����]�������0.5mol/L��������NaOH�������ʵ�飬��ʵ���в�õ��к��Ƚ�______ (����ƫ������ƫС������������)��
����]�������0.5mol/L��������NaOH�������ʵ�飬��ʵ���в�õ��к��Ƚ�______ (����ƫ������ƫС������������)��
(4)��ijͬѧ��������װ����ʵ�飬��Щ�������淶����ɲ���к�����ֵƫ�ͣ�����������ܵ�ԭ����__________��
A.����������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ� B.����Ͳ�е�����������Һ����С�ձ�ʱ�����ٻ� C.����ʵ��ĵ������½ϸ� D.����ȡ����ʱ���Ӷ��� E.���ձ��ĸǰ��м�С��̫��
���𰸡�Cu���ȿ�,������ʧ�� ���³鶯 ���װ�õı���Ч�� -56.8![]() ƫ�� ABE
ƫ�� ABE
��������
�к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹������������ȿ죬������ʧ�࣬�����к���ʱ����������η�Ӧ���¶Ȳ��ƽ��ֵ�����ݹ�ʽQ=cm��T���������0.05mol��ˮ�ų��������������к��ȵĸ��������Ӧ�ȡ�
��1�����ܽ����β����������Ϊͭ˿���������Ϊͭ˿��������ȵ������壬ʵ����ʹ�û��β���������IJ������������³鶯���ʴ�Ϊ��Cu���ȿ죬������ʧ�����³鶯��
��2���к��Ȳⶨʵ����ҪĿ���Dz�����Ӧ�ų����������٣���������к��Ȳⶨȷ�ԵĹؼ������װ�õı���Ч�����ʴ�Ϊ�����װ�õı���Ч����
��3����1��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.25�棬��Ӧǰ���¶Ȳ�Ϊ��3.45�棻
��2��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.40�棬��Ӧǰ���¶Ȳ�Ϊ��3.40�棻
��3��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ21.55�棬��Ӧǰ���¶Ȳ�Ϊ��3.35�棻
�������ݾ���Ч����ƽ��ֵΪ3.40�棻
50mL 0.50molL-1���ᡢ50mL 0.55molL-1 NaOH��Һ��������m=100mL��1g/mL=100g��c=4.18J/��g�棩�����빫ʽQ=cm��T������0.025mol��ˮ�ų�����Q=![]() = 56.8kJ������ʵ���õ��к��ȡ�H=-56.8kJ/mol���������ƹ�������ˮ���ȣ�����ʵ���в�õ��к�����ֵ��ƫ�ʴ�Ϊ��-56.8 kJ/mol��ƫ��
= 56.8kJ������ʵ���õ��к��ȡ�H=-56.8kJ/mol���������ƹ�������ˮ���ȣ�����ʵ���в�õ��к�����ֵ��ƫ�ʴ�Ϊ��-56.8 kJ/mol��ƫ��
��4��A������������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ����ڲ����¶�ʱ���ᷢ����ͼ���кͣ��¶�ƫ�ߣ����¶Ȳ��С��ʵ�����к��ȵ���ֵƫС����A�������⣻
B������Ͳ�е�����������Һ����С�ձ�ʱ�����ٻ����ᵼ��һ����������ɢʧ��ʵ�����к��ȵ���ֵƫС����B�������⣻
C������ʵ������ºͷ�Ӧ�ȵ�����֮���أ���C���������⣻
D������ȡ����ʱ���Ӷ�������ʹ��ʵ����ȡ���������Ҫ��ȡ���������ʹ���к��ȵIJⶨ����ƫ�ߣ���D���������⣻
E����50mL0.55mol/L����������Һȡ����50mL0.55mol/L�İ�ˮ�����ڰ�ˮ��������������ȹ��̣�ʵ�����к��ȵ���ֵƫС����E�������⡣
�ʴ�Ϊ��ABE��


 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��![]() ��Һ�и�����Ũ�ȵ���Դ�С��ϵʾ��ͼ��
��Һ�и�����Ũ�ȵ���Դ�С��ϵʾ��ͼ��
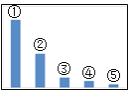
(1)����![]() �� ______��
�� ______��![]() ��������
��������![]()
(2)��![]() ��Һ�и���Ũ�ȵ�ʽ��ϵ��ȷ����_______
��Һ�и���Ũ�ȵ�ʽ��ϵ��ȷ����_______
a. ![]()
b. ![]()
c. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ��ܷϴ���(��Ҫ�ɷ�ΪCo��Fe��SiO2)Ϊԭ�ϣ���ȡ�����ܵ��������£�
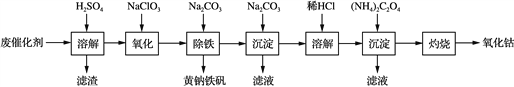
(1) �ܽ⣺�ܽ����ˣ�������ϴ��2��3�Σ��ٽ�ϴҺ����Һ�ϲ���Ŀ����________________________________________________________________________��
(2) ���������Ƚ��������¼���NaClO3����Fe2��������Fe3���������ӷ���ʽ��____________________________��
��֪�����軯�ػ�ѧʽΪK3[Fe(CN)6]�������軯�ػ�ѧʽΪK4[Fe(CN)6]��3H2O��
3Fe2����2[Fe(CN)6]3��===Fe3[Fe(CN)6]2��(��ɫ����)
4Fe3����3[Fe(CN)6]4��===Fe4[Fe(CN)6]3��(��ɫ����)
ȷ��Fe2���Ƿ�������ȫ�ķ�����__________________________________��(�ɹ�ѡ����Լ������軯����Һ�������軯����Һ�����ۡ�KSCN��Һ)
(3) ����������������Na2CO3������ȣ����ɻ�������[Na2Fe6(SO4)4(OH)12]������д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________________________________________��
(4) ���������ɳ�����ʽ̼����[(CoCO3)2��3Co(OH)2]��������ϴ�ӣ�ϴ�ӵIJ�����________________________________________________________________________��
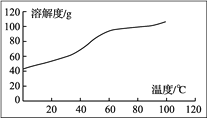
(5) �ܽ⣺CoCl2���ܽ��������ͼ��ʾ�����ʽ̼�����м�������ϡ���ᣬ���ȱ߽�������ȫ�ܽ������ȹ��ˣ���ԭ����__________________________________________��
(6) ���գ�ȷ��ȡCoC2O4 1.470 g���ڿ����г�����յ�0.830 g�����ܣ�д�������ܵĻ�ѧʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õ��з�̪���Ȼ�����Һʪ�����ֽ�ֱ����ס�������ʵ�飬�����жϴ�����ǣ� ��

A.b������������ð��B.d���������ֺ�ɫ
C.a��c���϶�����������ӦD.����������������������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2S2O35H2O�ڻ�ѧ���������г����������ʣ�ʵ�����Ʊ�ԭ��Ϊ��Na2CO3 + 4SO2 + 2Na2S![]() 3Na2S2O3+ CO2�����ͼ1װ��
3Na2S2O3+ CO2�����ͼ1װ��![]() �г�����ʡ��
�г�����ʡ��![]() ����ʵ�顣
����ʵ�顣
��A�з����Ļ�ѧ��Ӧ����ʽΪ ______��
��C����ʢ�Լ������� ______����ҪֹͣA�еĻ�ѧ��Ӧ����ȡ�¾ƾ���ֹͣ�����⣬�����Բ�ȡ�IJ����� ______��
��ѧ�����ڼ���A����Һ���µ�ͭ˿��ڣ���ͼ2���Ժ�ɫ�������ѧ��������¼��裺
�ٿ�����CuO �ڿ�����Cu2O �ۿ�����CuS��
ѧ������������һ���������������� ______������������ʵ���һ����֤��ɫ���ʵ���ɣ��������������������ɫ���ʵ����Ϊ ______ (�ѧʽ)
��ʵ������Na2S2O3��Һ����ij��ҵ��ˮ�е�I2��Ũ�ȡ�
��֪��I2 + 2S2O32�� = S4O62�� + 2I��
���Ե���Ϊָʾ������ζ��յ�������� ______ ��
������ҺNa2S2O3��Ũ��0.0030mol/L���ζ�25.00 mL��ҵ��ˮ���ĸ�Na2S2O3��Һ�������ͼ��ʾ����÷�ˮ��I2��Ũ��Ϊ ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���һ����̼��ԭ��������ʵ�������IJ������Ũ����Ȥ����ͨ��ʵ����̽����ɷ֡�
����ʵ��װ�ã�

��װ��B�з��������ӷ���ʽ�� ______��װ��B�������� ______��
����ʵ����������A�еķ�ĩ�ɺ�ɫ��Ϊ��ɫʱ��ֹͣ���ȣ�����ͨһ����̼����ȴ�����£�ֹͣͨ����ͬʱ�۲쵽�����ʯ��ˮ����ǡ�
����ʵ����ۣ�
����Ϊ����������ʵ����������жϳ����ɵĺ�ɫ����Ϊ��������
����Ϊ����������ʵ����������֤�����ɵĺ�ɫ����Ϊ��������������һ��ʵ�飺�ô���������ɫ���壬�����к�ɫ���屻�������������ǵó����ɵĺ�ɫ����Ϊ�������Ľ��ۡ�
����ͨ���÷�Ӧ��������϶����ǵĽ��������жϣ���ͨ��ʵ�����������ԣ�
����һ�������£�һ����̼���������ڼ��������£��ɷ������·�Ӧ��
CO +3Fe2O3 = 2Fe3O4+ CO2�� 4CO + Fe3O4 = Fe+ 4CO2��
������������(Fe3O4)Ϊ��ɫ���壬��ǿ���ԣ��ܹ�������������
�ס���ͬѧ�Ľ��� ______����Դ����۵������� ______��
����ʵ��̽��
�Է�Ӧ�����ɷ�������裺
����1����Ӧ�������ֻ��Fe��
����2����Ӧ�������ֻ��Fe3O4��
����3����Ӧ������� ______ ��
Ϊȷ��ʵ�����������еijɷ֣���ͬѧ�������ʵ�飬����������ѡ�Լ���������������ɸ�̽�����̣�������д�ڴ����Ӧλ�á�
��ѡ�Լ���������1mol/L CuSO4��0.01mol/L KSCN��Һ��1mol/L ���ᡢ0.01mol/L ��ˮ���Թܡ�����������ͷ�ιܡ�
ʵ����� | Ԥ������ͽ��� |
����һ��ȡӲ�ʲ������й�����������ֱ���A��B�Թ��У���������1mol/L CuSO4��Һ�������ܽ⡣ | ����A�Թ��к�ɫ���岻�ܽ⣬����û�й۲쵽�����������ɫ����Ϊ ______�� ����B�Թ����к�ɫ������������˵����ɫ�����к��� ______�� |
����������Թ�B����Һ���ˣ������ù���ϴ�Ӹɾ��������1mol/L����������ηֱ��������0.01mol/L��ˮ������0.01mol/L KSCN��Һ�� | ������Һ�����ɫ����______�� ������Һ���ɫ����______�� |
��������̽������ͬѧ��ͼͨ����Ӧǰ����������ı仯��ȷ����ɫ����ijɷ֣�����Ϊ������(�����������ڷ�Ӧ����ȫ��Ӧ)______(������������������)�������ǣ�______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
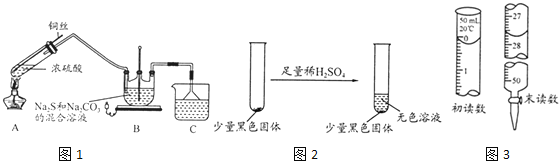
����Ŀ�����һ����ѧ�x��С�鴴����һ��ͨ��������⽫��������Ϊ��ѧ�ܵ�װ�á��������ƻ��ʵ������Ͷ�������Ϳ����������֮���ǿ�ͨ��H+�Ĺ���ۺ������ʡ���ṹ��ͼ��ʾ��������˵����ȷ����
A. ��Դ��b��Ϊ����
B. ������ת�������У�����������H+�������������ƶ�
C. �����缫��ӦʽΪ��OX + 4H+ + 4e���T GC + H2O
D. Ϊ��ǿ�������Һ�����ԣ�����ˮ����������NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ԫ�ػ�����Ļ�ѧ��������ȷ����
A.�����ӵĽṹʾ��ͼ��![]()
B.H��Cl�γɹ��ۼ��Ĺ��̣�![]()
C.Ǧ���طŵ�ʱ�ĸ�����Ӧ��Pb(s)��SO42��(aq)��2e��=PbSO4(s)
D.![]() ����
����![]() ���ɵ�����
���ɵ�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������η���E�����η���G��Ӧ�������������η���L��ֱ���η���M�����E�����е�Ԫ�ص�ԭ��������С��10�����G���ӵ�Ԫ��Ϊ�������ڵ�Ԫ�ء���Ӧ����ʾ��ͼ���£��������ж�����ȷ����( )��
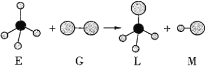
A.���³�ѹ�£�E��һ��Һ̬�л���B.M��һ�ֺ��зǼ��Լ��ķ���
C.�����G��Ư��ʪ�����ɫ����D.������Ӧ�������Ǽӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com