
【题目】2018年5月9日科技网报道,最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇。
(1)甲醇燃烧时发生如下反应(a、b、c、d均大于0):
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H1=-akJ·mol-1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) △H2=-bkJ·mol-1
③CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) △H3=-ckJ·mol-1
④CH3OH(1)+O22(g)=CO (g)+2H2O(1) △H4=-dkJ·mol-1
由此知,a、b、c、d由小到大排序为_______。
(2)工业上,通常采用氢气还原CO2法制备甲醇CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(1) △H
CH3OH(g)+H2O(1) △H
已知几种化学键的键能数据如下:
共价键 | C=O | H-H | C-O | C-H | H-O |
键能/kJ·mol-1 | 803 | 436 | 326 | 414 | 464 |
根据键能数据估算上述反应中△H=____________kJ·mol-1。
(3)在2L恒容密闭容器中充入2 mol CO2和6.5mlH2,在一定温度下反应,测得混合气体中c(CH3OH)与时间的关系如图1所示。

①M点CO2的正反应速率___________N点CO2的逆反应速率(选填“大于”“小于”或“等于”)。
②0~10min内H2的平均反应速率v(H2)=___________mol·L-1·min-1。
③在该温度下,该反应平衡常数K为________。(结果保留两位小数并要求带单位)
(4)在密闭容器中充入一定量CO2和H2,在含铂催化剂作用下反应,测得单位时间内CO2的转化率与温度关系如图2所示。
①R点对应的CO2转化率最大,其原因是_________________。
②在Q点时CO2的转化率突变的原因可能是_________________。
(5)以石墨为电极,甲醇/空气碱性(KOH溶液为电解质溶液)燃料电池的能量转化效率高。当KOH恰好完全转化成KHCO3时停止放电,此时负极的电极反应式为_____________。
【答案】 d、c、a、b(或d<c<a<b ) -46 大于 0.225 2.25 (Lmin-1)2 R点之前未达到平衡,温度升高,反应速率加快,单位时间内转化率增大;R点为平衡点,该反应正反应是放热反应,R点之后,升温平衡向左移动,转化降低 Q点对应的温度使催化剂失去活性(或该温度下催化剂的选择性降低) CH3OH-6e-+7OH-=HCO3-+5H2O
【解析】(1)根据产物、状态、化学计量数判断,液态变气态时要吸收热量,放出热量分析判断;
(2)根据反应热等于断裂化学键的总键能与形成化学键的总键能之差计算;
(3)①根据M点未达到平衡,向正方向进行;N点达到平衡,正、逆反应速率相等分析判断;②根据υ(H2)=![]() 计算;③利用三段式计算出平衡时四种物质的浓度,再根据K=
计算;③利用三段式计算出平衡时四种物质的浓度,再根据K=![]() 计算;
计算;
(4)①分析R点转化率最大,可以从两个角度一是平衡前,温度对反应速率的影响,单位时间内转化率,其实与速率相关。二是平衡后,升温,平衡移动;②从催化剂活性角度解释Q点转化率突变;
(5)负极上甲醇发生氧化反应,氧化产物为KHCO3,据此书写负极的电极反应式。
(1)①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H1=-akJ·mol-1;②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) △H2=-bkJ·mol-1;③CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) △H3=-ckJ·mol-1;④CH3OH(1)+O22(g)=CO (g)+2H2O(1) △H4=-dkJ·mol-1;根据产物、状态、化学计量数判断,液态变气态时要吸收热量,放出热量:②>①>③>④,故d<c<a<b,故答案为:d<c<a<b;
(2)反应热等于断裂化学键的总键能与形成化学键的总键能之差。ΔH=(803×2+436×3-326-414×3-464-464×2)kJ·mol-1=-46 kJ·mol-1,故答案为:-46;
(3)①M点未达到平衡,向正方向进行,正反应速率减小;N点达到平衡,正、逆反应速率相等,所以,M点正反应速率大于N点逆反应速率,故答案为:大于;
②υ(H2)=![]() mol·L-1min-1=0.225 mol·L-1min-1,故答案为:0.225;
mol·L-1min-1=0.225 mol·L-1min-1,故答案为:0.225;
③ CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 1 3.25 0 0
转化浓度(mol/L) 0.75 2.25 0.75 0.75
平衡浓度(mol/L) 0.25 1.00 0.75 0.75
K=![]() =
=![]() (Lmin-1)2=2.25 (Lmin-1)2,故答案为:2.25 (Lmin1)2;
(Lmin-1)2=2.25 (Lmin-1)2,故答案为:2.25 (Lmin1)2;
(4)①单位时间内反应物转化率与速率有关。分析R点转化率最大,从两个角度考虑:一是平衡前,温度对反应速率的影响,单位时间内转化率,其实与速率相关。二是平衡后,升温,平衡移动。即R点之前未达到平衡,温度升高,反应速率加快,单位时间内转化率增大;R点为平衡点,该反应正反应是放热反应,升温平衡向左移动,转化降低,故答案为:R点之前未达到平衡,温度升高,反应速率加快,单位时间内转化率增大;R点为平衡点,该反应正反应是放热反应,R点之后,升温平衡向左移动,转化降低;
②从催化剂活性角度解释Q点转化率突变。即Q点对应的温度使催化剂失去活性(或该温度下催化剂的选择性降低),故答案为:Q点对应的温度使催化剂失去活性(或该温度下催化剂的选择性降低);
(5)负极上甲醇发生氧化反应,氧化产物为KHCO3。故负极的电极反应式为CH3OH-6e+7OH=HCO3+5H2O,故答案为:CH3OH-6e+7OH=HCO3+5H2O。


科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论错误的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. ②中红棕色气体不能表明木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在常温下一定能大量共存的是( )
A. Na2S溶液中:SO![]() 、K+、Cl-、Cu2+
、K+、Cl-、Cu2+
B. 在c(H+)/c(OH-)=1012的溶液中:NH![]() 、NO
、NO![]() 、K+、Cl-
、K+、Cl-
C. 加入铝粉能放出H2的溶液中:Mg2+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
D. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
A.混合物:空气、有色玻璃、水银
B.碱:Ba(OH)2、Cu2(OH)2CO3、NH3·H2O
C.盐:醋酸钠、氯化铵、纯碱
D.氧化物:H2O、CO、HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可成甘油、医药、农药香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的价电子排布式为___________________。
(2)1 mol CH2=CH-CH2OH含__________molσ键,烯丙醇分子中碳原子的杂化类型为_____________。
(3)丙醛(CHCH2CHO)的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______________________________。
(4)羰基镍[Ni(CO)4)用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是_________________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空间构型是_____________,与SCN-互为等电子体的分子为____________。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为____________。
②已知:氧化镍晶胞密度为dg·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为__________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮的化合价为+3
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5molH2S中,约含有________________个氢原子,共有_________mol原子,其质量为____________克,在标况下体积为_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA为一元酸,常温下向20mL0.01mol/L的HA溶液中滴加0.01mol/L的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图所示。下列说法不正确的是
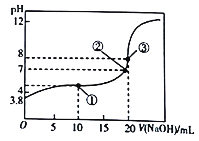
A. 常温下,该酸的电离常数K=10-5.6
B. 该测定过程中不可以选择甲基橙为指示剂
C. 滴定至①处时,溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-)
D. 由①到③过程中,水的电离程度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com