
���ĺϳ�������Ҫ�Ļ�������֮һ��
I����ҵ�Ϻϳɰ��õ�H2�ж�����ȡ�ķ�����
�� �ý�̿��ˮ��Ӧ�� C(s��+ H2O(g) 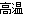 CO(g��+ H2(g)��
CO(g��+ H2(g)��
�� ����Ȼ����ˮ������Ӧ��CH4(g��+ H2O(g�� CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
��֪�йط�Ӧ�������仯����ͼ�������з�Ӧ�Ħ�H =__________ ___��
����3��1L���ܱ������У�ͬ�¶��¡�ʹ����ͬ�����ֱ���з�Ӧ��
3H2(g��+ N2(g�� 2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���Ӧ�ﵽƽ��ʱ�й�����Ϊ��
2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���Ӧ�ﵽƽ��ʱ�й�����Ϊ��
�� �� | �� | �� | �� |
��Ӧ��Ͷ���� | 3 mol H2��2 mol N2 | 6 mol H2��4mol N2 | 2 mol NH3 |
�ﵽƽ���ʱ�䣨min�� | t | 5 | 8 |
ƽ��ʱN2��Ũ�ȣ�mol��L-1�� | c1 | 3 |
|
N2��������� | ��1 | ��2 | ��3 |
��������ܶȣ�g��L-1�� | ��1 | ��2 |
|
(1��������˵���÷�Ӧ�Ѵﵽƽ��״̬����
a��������N2��H2��NH3��Ũ��֮��Ϊ1�U3�U2
b��v��N2������3v��H2����
c��������ѹǿ���ֲ���
d�����������ܶȱ��ֲ���
(2���������дﵽƽ������Ҫ��ʱ��t 5min (��>��< ��=)
(3�����дӷ�Ӧ��ʼ��ƽ��ʱN2��ƽ����Ӧ���� ��ע����λ����
(4�������ϱ����ݣ����й�ϵ��ȷ����________��
a��2c1 =3mol/L b����1 = ��2 c��2��1 = ��2
(5�����¶��£��������У��÷�Ӧ��ƽ�ⳣ��K=____ __���÷�����ʾ����mol/L����2��
��16�֣�I����H =��a+3b-c��( 3�֣�
��(1��c��3�֣���
(2��t > 5 ��2�֣���
(3��0��2 mol��L-1��min-1��2�֣�����1�֣���λ1�֣�
(4��c��3�֣���
(5��K= 4/81��3�֣�
��������
���������I����ͼ֪CO(g)+1/2O2(g)=CO2(g����H=-akJ/mol �� ��
H2(g)+1/2O2(g)= H2O(g�� ��H=-bkJ/mol�� ��
CH4(g)+2O2(g)= 2H2O(g)+ CO2(g�� ��H=-ckJ/mol �ۣ����ݸ�˹���ɵ÷������з�Ӧ�Ħ�H =��-��-�ڡ�3=-c-(-a)-(-b)��3=��a+3b-c��kJ/mol��
��(1)a��ƽ��ʱ������N2��H2��NH3��Ũ��֮�Ȳ�һ��Ϊ1�U3�U2������b�����ݻ�ѧ����ʽ��3v��N2������v��H2���� ������c������������䣬һ���¶��£����ŷ�Ӧ�Ľ��У���������ʵ����ڼ��٣�����������ѹǿ��С����ƽ��ʱ��ѹǿ���ٱ仯����ȷ��d�����������غ㶨�ɣ��ú��������е�������ܶ�һֱ���䣬�����ж�ƽ��״̬�ĵ������ѡc��
��2�������ұȣ���Ӧ���Ũ��С�����Է�Ӧ����������ƽ���ʱ�䳤����t>5min��
��3�������ij�ʼŨ����4mol/L��ƽ��Ũ����3mol/L�����Ե�����Ũ�ȼ���1mol/L�������е�����ƽ����Ӧ����Ϊ1mol/L/5min=0��2mol��L-1��min-1
(4)����ױȣ��ҵķ�Ӧ��Ũ���Ǽ�2�����൱���ڼ�ƽ��Ļ������ֳ���3 mol H2��2 mol N2����ƽ�ⲻ�ƶ�����2c1 =3mol/L����1 = ��2����ʵ���ں��º���ʱ����Ӧ���Ũ��ƽ�������ƶ�������3>2c1����2 >��1 ��ab�����ں��������µĿ��淴Ӧ����ϵ�и����ʾ������壬���е����������Ǽ�������������2���������ҵ��ܶ�Ҳ�Ǽ�2����c��ȷ����ѡc��
(5)���ݣ�3���ļ��㣬���ĵ���1mol/L����������3mol/L�������ɰ���2mol/L�����¶��£��������и����ʵ�ƽ��Ũ�ȷֱ�Ϊc��N2��=3mol/L��c��H2��=3mol/L��c��NH3��=2mol/L������
K= c��NH3��2/ c��N2����c��H2��3=4/81��mol/L����2
���㣺�����˹���ɵ�Ӧ�ã���ѧ��Ӧ���ʵļ��㣬��ѧƽ��״̬���жϣ���ͬƽ��״̬�ıȽϣ���ѧƽ�ⳣ���ļ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�ع��и���4�¸߿���ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������ʵ��װ�ý��е���Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���
A��ͼ1��ʾװ�ÿ��Ʊ�����
B��ͼ2��ʾװ�ÿɷ���CH3CH2OH��CH3COOC2H5�Ļ��Һ
C��ͼ3��ʾװ�ÿ��Ʊ����ռ���ϩ����֤���ױ�����
D��ͼ4��ʾװ�ÿ��Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�����������������ȷ����( )
A�������£�9g H2O�к�NA��O�CH��
B��1 molFe2+������ϡ���ᷴӦ��ת��3 NA������
C�����³�ѹ�£�22. 4L SO2��O2�Ļ�������к�2NA����ԭ��
D��0. 1 mol��L�C1KAl(SO4)2��Һ�к�0.2NA��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и����ڶ��ε��п������ۻ�ѧ�Ծ��������棩 ���ͣ������
�����ڿ��С��������й㷺Ӧ�á�
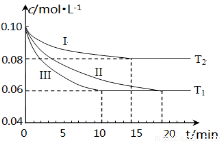
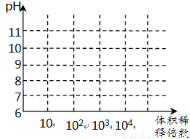
��1��������1L�ĺ����ܱ������У��ֱ����0.1mol N2��0.3mol H2������ӦN2��g��+3H2��g�� 2NH3��g����H1��0��ʵ�����c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��T��ʾ�¶ȣ���
2NH3��g����H1��0��ʵ�����c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��T��ʾ�¶ȣ���
��ʵ�����ǰ10������N2ƽ����Ӧ����v��N2��= ����д��������̣�
����ʵ�����ȣ�ʵ���ʵ���ֱ���õ�ʵ����������Ϊ �� ��
��2��������NH4����aq��+H2O��l�� NH3?H2O��aq��+H����aq���Ļ�ѧƽ�ⳣ��Ϊ5.55��10��10 mol��L-1����NH3?H2O�ĵ���ƽ�ⳣ��K= ��������λ��Ч���֣���
NH3?H2O��aq��+H����aq���Ļ�ѧƽ�ⳣ��Ϊ5.55��10��10 mol��L-1����NH3?H2O�ĵ���ƽ�ⳣ��K= ��������λ��Ч���֣���
��3�������£���1mL pH��Ϊ11�İ�ˮ��NaOH��Һ�ֱ��ˮϡ�ͣ�������ͼ�л�������Һ��pH�����ϡ�ͱ����ı仯���ߣ��ӱ�Ҫ��ע����
��4����ҵ����NH3����NO��Ⱦ����һ�������£���֪ÿ��ԭ1molNO���ų�����120kJ������������Ȼ�ѧ����ʽ�� NO(g)�� NH3(g)�� N2(g)�� (g) ��H2�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и����ڶ��ε��п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
NAΪ����٤������������˵����ȷ���ǣ� ��
A��ͬ��ͬѹͬ�����CO2��SO2������ԭ������Ϊ2NA
B��32gCu��S��ȫ��Ӧת�Ƶĵ�����ΪNA
C��1L 1.0mol��L-1NH4Cl��2L 0.5mol��L-1NH4Cl��Һ��NH4+��Ŀ��ͬ
D��25��ʱ��pH=13��1.0 L Ba(OH)2��Һ�к��е�OH-��ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и���4��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�״���������ǿ����Һ������ʵ��ֻ�����еķ�ӦΪ��
2CH3OH+3O2+4OH- 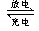 2CO32-+6H2O���й�˵����ȷ����
2CO32-+6H2O���й�˵����ȷ����
A���ŵ�ʱ��CH3OH���뷴Ӧ�ĵ缫Ϊ����
B���ŵ�ʱ�������缫��Ӧ��CH3OH+8OH--6e- =CO32-+6H2O
C������£�ͨ��11��2LO2��ȫ��Ӧ��1mol����ת��
D�����ʱ�������Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����з�خ���߿�ͳ����һ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
�Դ�����Ⱦ��SO2��NOx�����о�������Ҫ�������塣��ش��������⣺
��1��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�ǽ�úת��Ϊ�������ȼ�ϡ�
��֪���� H2��g����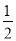 O2(g)=H2O(g) ��H����241.8kJ��mol��1
O2(g)=H2O(g) ��H����241.8kJ��mol��1
��C��s����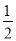 O2(g)=CO(g) ��H����110.5kJ��mol��1
O2(g)=CO(g) ��H����110.5kJ��mol��1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ�� ��
��2����֪��������������NO�ķ�ӦΪ��N2(g)��O2(g) 2NO(g) ��H
2NO(g) ��H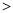 0����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��2.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ1.6��10��3mol��
0����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��2.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ1.6��10��3mol��
����1300oC ʱ���÷�Ӧ��ƽ�ⳣ������ʽK�� ��5s�ڸ÷�Ӧ��ƽ�����ʦ�(N2) �� ������2λ��Ч���֣���
�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���� ��
��3������β����NO��CO��ת��������������һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ��ʾ��������������ʱ����Ӧ2NO(g)��2CO(g)  2CO2(g)��N2(g) �У�NO��Ũ��c(NO)���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�
2CO2(g)��N2(g) �У�NO��Ũ��c(NO)���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�
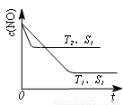
�ٸ÷�Ӧ�ġ�H 0 ���������������
���������ı����S1��S2������ͼ�л���c(NO) ��T1��S2�����´ﵽƽ������еı仯���ߣ�������Ӧ��ע����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����б�ҵ���ۺϲ��ԣ��������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ˮ��Һ���ܴ��������һ��������
A��H+��NO3����I����Cl��
B��Cu2+��Br����H+��SO42��
C��Al3+��Mg2+��CO32����NO3��
D��NH4+��Cl����OH����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�����и���4��ģ�⿼�ԣ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
þ�����������仯���������������������Ź㷺��Ӧ��
I��ʵ���Ҳ���MgCl2��AlCl3�Ļ����Һ�������ˮ��Ӧ�Ʊ�MgAl2O4����Ҫ�������£�
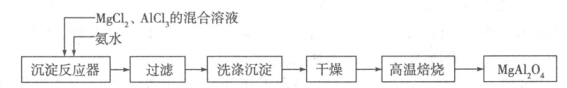
��1����֪25��ʱKsp[Mg(OH)2]=1��8��10-11��Ksp[Al(OH)3]=3��10-34�����¶�����Ũ�Ⱦ�Ϊ0��01 mol��L-1��MgCl2��AlCl3�����Һ����μ��백ˮ�������� ����(�ѧʽ)��
��2�����±���ʱ������Ӧ�Ļ�ѧ����ʽ ��ϴ�ӳ���ʱ�ķ����� ��
��3�������������AlCl3������Һ�в���ͨ��HCl���壬������AlCl3��6H2O���壬��ϻ�ѧƽ���ƶ�ԭ���������������ԭ�� ��
��ij��ȤС���ͬѧ���ֽ�һ����������Ũ�������ʱ���۲쵽����ȫ�ܽ⣬�������������塣Ϊ�ˣ��������������װ����֤�����������塣
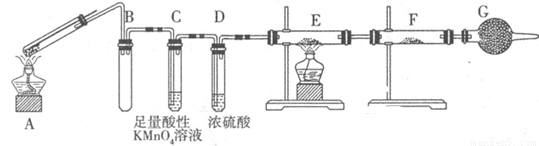
��1��Gװ�õ������� ��
��2��֤����SO2���ɵ������� ��Ϊ��֤�������к���������װ��E��F�м�����Լ��ֱ�Ϊ �� ��
��3��������˿����ͭ˿����Ӧ�����Һû�г���Ԥ�Ƶ���ɫ��Һ���������˴�����ɫ���壬ԭ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com