
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
分析 甲烷完全燃烧生成CO2和H2O,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,固体相当于吸收CO,水蒸汽与过氧化钠发生反应:2H2O+2Na2O2=4NaOH+O2,固体吸收相当于H2,由于恢复至室温,发现容器为真空,说明气体完全被吸收,则CH4与O2的混合组成可以表示为xCO.yH2,由C、O原子数目之比可知CH4与O2的体积之比.
解答 解:甲烷完全燃烧生成CO2和H2O,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,固体相当于吸收CO,水蒸汽与过氧化钠发生反应:2H2O+2Na2O2=4NaOH+O2,固体吸收相当于H2,由于恢复至室温,发现容器为真空,说明气体完全被吸收,则CH4与O2的混合组成可以表示为xCO.yH2,由C、O原子数目之比可知,CH4与O2的物质的量之比为2:1,
相同条件下气体体积之比等于物质的量之比,则原混合气中CH4与O2的体积比为2:1,
故选A.
点评 本题考查化学方程式的计算,题目难度不大,注意根据方程式理解固体吸收物质组成,侧重考查学生分析思维与解题方法技巧的能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
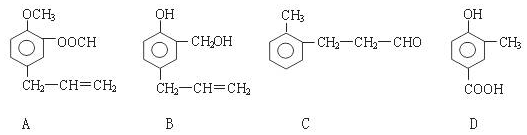
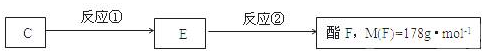
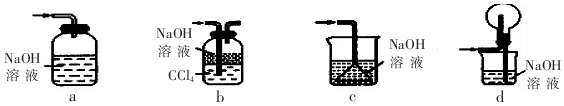
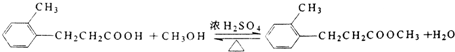 ;.
;.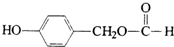 ;H:
;H: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
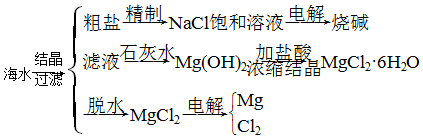
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵减的吸热反应可能是自发反应 | |
| B. | 需要加热的化学反应,生成物的总能量一定高于反应物的总能量 | |
| C. | 使用催化剂既不会改变反应的限度又不会改变反应的焓变 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.2}{{t}_{1}}$mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=0.32 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com