
【题目】2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如右图所示),其特殊的电子结构将有望广泛应用于电子材料领域。下列说法不正确的是( )
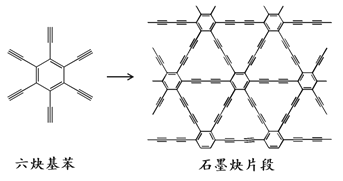
A.六炔基苯的化学式为C18H6
B.六炔基苯和石墨炔都具有平面型结构
C.六炔基苯和石墨炔都可发生加成反应
D.六炔基苯合成石墨炔属于加聚反应
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)已知反应②中相关化学键键能数据如下:
化学键 | H-H | C=O | C≡O | H-O |
E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2) 一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
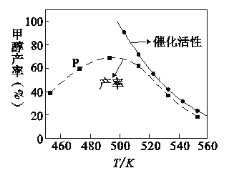
①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态,490K之后,甲醇产率随温度升高而减小的原因除了升高温度使反应①平衡逆向移动以外,还有___________________________________________________________、______________________________________________________________________。
②一定能提高甲醇产率的措施是______。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2+H2,CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。
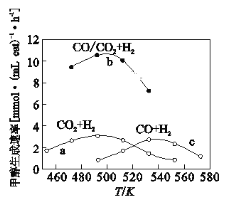
①490K时,根据曲线a、c判断合成甲醇的反应机理是______(填I或II)
Ⅰ.CO2![]() CO
CO![]() CH3OH
CH3OH
II.CO![]() CO2
CO2![]() CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应①、②分析原因___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃ 时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )

A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水,反应的离子方程式为![]() +Cl2+H2O=
+Cl2+H2O=![]() +Cl-+ClO-
+Cl-+ClO-
C.向0.1mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,![]() 先形成沉淀
先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
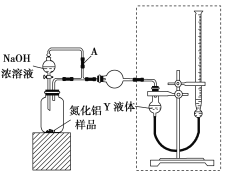
【题目】氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝并检验其纯度。查阅资料:
①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
②工业制氮化铝:Al2O3+3C+N2高温,2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O===NaAlO2+NH3↑。
Ⅰ.氮化铝的制备
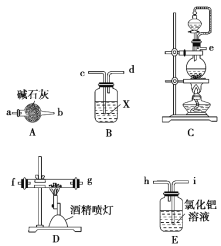
(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→a→b→____________________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是_____________,E装置内氯化钯溶液的作用可能是_____。
Ⅱ.氮化铝纯度的测定
(方案ⅰ)甲同学用如图装置测定AlN的纯度(部分夹持装置已略去)。
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是________。
a.CCl4 b.H2O
c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是________(填“偏大”“偏小”或“不变”)。
(方案ⅱ)乙同学按以下步骤测定样品中AlN的纯度。
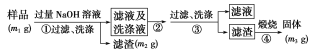
(5)步骤②通入过量________气体。
(6)步骤③过滤所需要的主要玻璃仪器有____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中,以丙烯、氨、氧气为原料,在催化剂存在下生产丙烯腈(C3H3N),反应的热化学方程式为:2C3H6(g)+2NH3(g)+3O2(g) ![]() 2C3H3N(g)+6H2O(g) △H= -1030kJ·mol-1。在其他条件和反应时间相同时,丙烯腈产率与反应温度的关系曲线如图所示。下列有关说法错误的是( )
2C3H3N(g)+6H2O(g) △H= -1030kJ·mol-1。在其他条件和反应时间相同时,丙烯腈产率与反应温度的关系曲线如图所示。下列有关说法错误的是( )
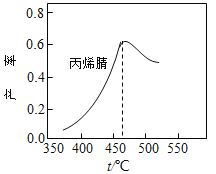
A.低于460℃时,丙烯腈的产率随温度升高而升高,是因为升高温度,反应速率加快
B.高于460℃时,丙烯腈的产率随温度升高而降低,可能与温度度升高,化学平衡逆向移动有关
C.其他条件不变,降低温度有利于提高丙烯腈平衡产率
D.投料比不变,增加反应物的浓度有利于提高丙烯腈平衡产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往一体积不变的密闭容器中充入H2和I2,发生反应 H2(g)+I2(g)![]() 2HI(g);△H>0达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
2HI(g);△H>0达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度不变
C.由于压强增大,导至H2,I2(g),HI平衡浓度都增大
D.改变的条件是升温,速率图象为下图

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g);ΔH=-90.8kJ/mol。
CH3OH(g);ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=____,如升高温度,K值将______(填:增大、减小或不变)。
(2)以下各项能说明该反应达到平衡状态的是____________.
A.混合气体的密度保持不变 B.甲醇的质量分数保持不变
C.CO的浓度保持不变 D.2v逆(H2)=v正(CH3OH)
(3)在210°C、240°C和270°C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
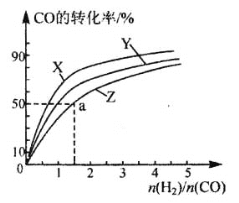
如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_____。由起始达到a点所需时间为5min,则H2的反应速率为:_______________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
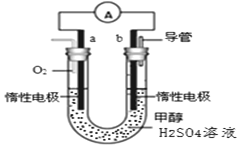
①该电池工作时,正极是____________极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年7月1日起,上海进入垃圾分类强制时代,随后西安等地也纷纷开始实行垃圾分类。这体现了我国保护环境的决心,而环境保护与化学息息相关,下列有关说法错误的是(![]() )
)
A.可回收的易拉罐中含金属铝,可通过电解熔融氧化铝制取
B.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
C.废弃的聚乙烯塑料属于白色垃圾,不能使溴水褪色
D.废旧电池中含有镍、镉等重金属,不能用填埋法处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中下列各物质间不能实现 (“→”表示一步完成)转化的是
(“→”表示一步完成)转化的是
选项 | A | B | C | D |
a | CH3CH2OH | CH2=CH2 | Cl2 | C |
b | CH3CHO | CH3CH2Br | HClO | CO |
c | CH3COOH | CH3CH2OH | HCl | CO2 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com