
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)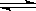 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
向1L含0.01molNaAlO2和0.02molNaOH 的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01mol < n(CO2) < 0.015 mol时发生的反应是:2 NaAlO2 + CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01mol < n(CO2) < 0.015 mol时发生的反应是:2 NaAlO2 + CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
D | 0.03 | c(Na+)> c(HCO3- |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:填空题
某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成图①所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素。
(1)X元素在常规周期表中的位置 (填周期和族)。
(2)写出M与Z两种元素形成的化合物的电子式 。
(3)下列说法正确的是_______
a.Z元素对应的氢化物比K元素对应的氢化物沸点高
b.虚线相连的元素处于同一主族
c.K、L、X三种元素的离子半径大小顺序是X3+>L +>K 2?
d.由K、L两种元素组成的化合物中可能含有共价键
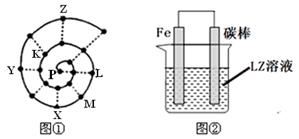
(4)图②装置可以模拟钢铁的腐蚀,铁棒一极的电极反应式是 。若在图②溶液中滴加少量酚酞溶液并进行电解,发现Fe电极附近溶液变红,写出该电解池的离子方程式 _。牺牲阳极的阴极保护法利用的是 _原理(填“电解池”或“原电池”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
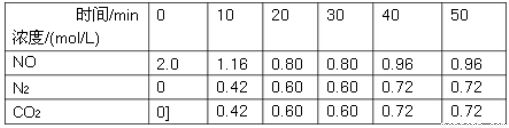
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(N2)=________mol/(L•min);计算该反应的平衡常数K=___________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是________(填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率________(填“升高”或“降低”),ΔH________0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)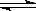 CH3OH(g)+H2O(g)△H1=-49.1kJ/mol
CH3OH(g)+H2O(g)△H1=-49.1kJ/mol
2CH3OH(g)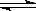 CH3OCH3(g)+H2O(g)△H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g)△H2=-24.5kJ/mol
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式__________________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:__________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)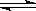 3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
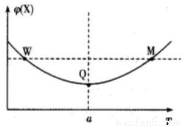
A.升高温度,平衡常数增大
B.W点X的正反应速率小于M点X的正反应速率
C.Q点时,Y的转化率最小
D.平衡时充入Z,达新平衡时Z的体积分数比原来大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.理论上任何氧化还原反应都可以设计成原电池。
B.甲烷的标准燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)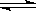 2NH3(g)△H=-38.6 kJ/mol
2NH3(g)△H=-38.6 kJ/mol
D.同温同压下,等量的氢气完全发生反应:H2(g)+Cl2(g)=2HCl(g),在点燃条件下放出的热量与光照条件下放出的热量相等。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
将标准状况下体积为2.24L的H2S缓慢通入100rnl 1.5mol/LNaOH溶液中(溶液体积变化忽略不计)充分反应后,下列关系式中错误的是
A.c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
B.c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-)
C.c(Na+)>c(HS-)+c(S2-)+c(H2S)
D.c(HS-)+c(S2-)+c(H2S)=1.0mol.L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
C.稀溶液中:H+(aq)+OH-(aq)==H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含lmol
NaOH的稀溶液混合,放出的热量大于57.3kJ
D.25℃101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ的热量,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g) = 2H2O(l);△H=-571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2, 在不同温度下反应CO2(g)+c(s)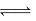 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
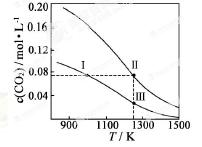
A.反应CO2(g)+C(s)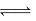 2CO(g)的 △S>0、△H<0
2CO(g)的 △S>0、△H<0
B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)>2c(CO,状态Ⅲ)
D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com