
| A. | 1.0Ll.0mol.L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 25C时pH=11的Na2C03溶液中水电离出的OH-的数目为0.001NA | |
| D. | 氧原子总数为0.2NA的S02和O2的混合气体,其体积为2.24L |
分析 A、在偏铝酸钠溶液中,除了偏铝酸钠本身,水也含氧原子;
B、丙烯和环丙烷的分子式均为C3H6;
C、溶液体积不明确;
D、混合气体所处的状态不明确.
解答 解:A、在偏铝酸钠溶液中,除了偏铝酸钠本身,水也含氧原子,故溶液中含有的氧原子的个数大于2NA个,故A错误;
B、丙烯和环丙烷的分子式均为C3H6,故42g混合物的物质的量为1mol,故含6NA个氢原子,故B正确;
C、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故C错误;
D、S02和O2中均含2个氧原子,故氧原子总数为0.2NA的S02和O2的混合气体的物质的量为0.1mol,但混合气体所处的状态不明确,故体积无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 汽油中绝不含铅元素 | B. | 汽油中不人为添加含铅元素的物质 | ||
| C. | 汽油中含铅元素在一定指标范围内 | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 | |
| B. | 图①中使用的NaOH的浓度为2 mol/L | |
| C. | 图②表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| D. | 图③中曲线表示3H2(g)+N2(g)═2NH3(g)反应过程的能量变化.若使用催化剂,B点会降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①③⑤ | C. | ①③④⑦ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
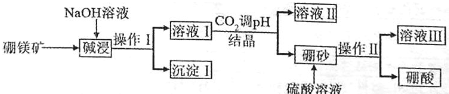
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O和18O的原子结构示意图均为 | |
| B. | 在Na2O2和CaCl2中均含有共价键和离子键 | |
| C. | 结构示意图为  的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
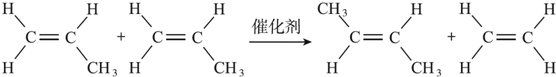
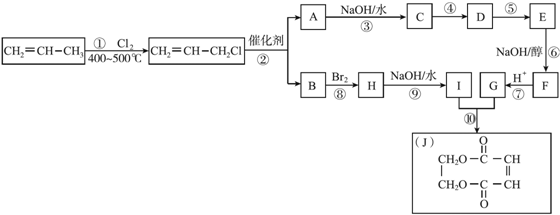
 +CH2=CH2.
+CH2=CH2.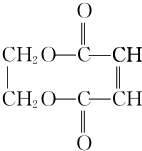 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com