
| 性质 | 用途 | |
| A | HF溶液具有酸性 | 能用HF溶液在玻璃上刻图案 |
| B | SO2具有强还原性 | SO2常用于漂白秸秆、织物 |
| C | CuSO4具有氧化性 | CuSO4和熟石灰配波尔多液 |
| D | CH3CH2OH燃烧放出大量热量 | 酒精常作清洁能源 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氟酸能够与玻璃中二氧化硅反应生成四氟化硅和水;
B.依据二氧化硫的漂白性解答;
C.重金属离子能够使蛋白质变性;
D.依据乙醇能够燃烧生成水、二氧化碳,放出大量的热解答.
解答 解:A.氢氟酸能够与玻璃中二氧化硅反应生成四氟化硅和水,能腐蚀玻璃,与氢氟酸的酸性无关,故A错误;
B.SO2常用于漂白秸秆、织物,是因为二氧化硫具有漂白性,与其还原性无关,故B错误;
C.CuSO4和熟石灰配波尔多液具有杀菌消毒作用是因为铜离子为重金属离子,与硫酸铜的氧化性无关,故C错误;
D.乙醇能够燃烧生成水、二氧化碳,放出大量的热,所以酒精常作清洁能源,故D正确;
故选:D.
点评 本题考查了元素化合物性质与用途,掌握常见的物质的性质和用途的关系是正确解答本题的关键,注意对相关知识的积累,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 明矾净水过程中不涉及化学变化 | |
| B. | 由同种元素组成的物质不一定是纯净物 | |
| C. | 风化、石油分馏和碘的升华都是物理变化 | |
| D. | 在化学反应中,反应前后原子种类、数目和质量一定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家最近发明“可充电Na-CO2电池”,示意图如图.该电池的工作原理为:4Na+3CO2$?_{放电}^{充电}$2Na2CO3+C.下列说法错误的是( )
我国科学家最近发明“可充电Na-CO2电池”,示意图如图.该电池的工作原理为:4Na+3CO2$?_{放电}^{充电}$2Na2CO3+C.下列说法错误的是( )| A. | 放电时,Na+由钠箔端向多壁碳纳米管端移动 | |
| B. | 放电时,正极的电极反应为:3CO2+4Na++4e-═2Na2CO3+C | |
| C. | 该电池不宜在高温下使用 | |
| D. | 充电时,钠箔与外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述转化属于分解反应 | B. | 上述反应过程放出大量热 | ||
| C. | 生成的CaO可作氯气的干燥剂 | D. | CaCO3水泥的主要成分之一. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| B | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| C | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
| D | Cl2具有酸性 | Cl2可与石灰乳或烧碱反应制备含氯消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
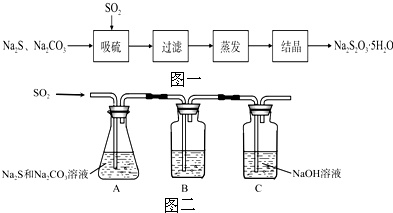
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上 层清液pH>10.2 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 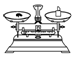 |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 饱和氯水中:K+、Na+、Cl-、HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com